
【題目】實驗室提供下列藥品:碳酸鈉固體、塊狀大理石、粉末狀大理石、稀硫酸、稀鹽酸和濃鹽酸;A、B、C、D、E、F、G、H等裝置和試管等儀器.
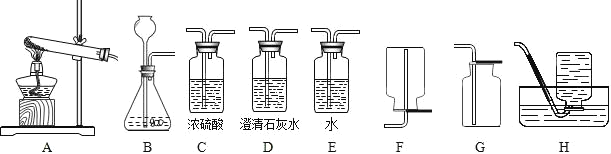
(1)制取CO2的發生裝置選_____(填序號),按要求連接好裝置后,在裝入藥品之前必不可少的操作_____.制CO2的裝置還可以用來制取_____氣體,其反應原理是:_____(用化學方程式表示).將裝置A和裝置H連接可制取我們常見的_____氣體.
(2)檢驗二氧化碳的方法用化學方程式表示為_____.
(3)在四支試管中取等量固體和稀硫酸、稀鹽酸反應,現象如表.
反應物 | ①粉末狀大理石 +稀鹽酸 | ②碳酸鈉固體 +稀硫酸 | ③塊狀大理石 +稀鹽酸 | ④塊狀大理石 +稀硫酸 |
現 象 | 劇烈,瞬間完成 | 劇烈,瞬間完成 | 有平穩氣流產生 | 很慢,稍后停止 |
由此推知,實驗室用于制取CO2的藥品最合理的是_____(填序號);該反應的反應方程式為:_____.
(4)若要制取干燥的CO2,所有裝置的連接順序為_____.
(5)若不慎用濃鹽酸代替稀鹽酸制得了CO2氣體,要得到純凈干燥的CO2,所有裝置的連接順序為_____.
【答案】B 檢查裝置的氣密性 氧氣或氫氣 2H2O2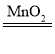 2H2O+O2↑(或Zn+H2SO4=ZnSO4+H2↑) 氧氣 Ca(OH)2+CO2═CaCO3↓+H2O ③ CaCO3+2HCl═CaCl2+CO2↑+H2O BCG BECG
2H2O+O2↑(或Zn+H2SO4=ZnSO4+H2↑) 氧氣 Ca(OH)2+CO2═CaCO3↓+H2O ③ CaCO3+2HCl═CaCl2+CO2↑+H2O BCG BECG
【解析】
(1)實驗室是用石灰石和稀鹽酸在常溫下來制取二氧化碳的,反應物是固體和液體,不需要加熱,發生裝置可選用B;制氣體時,連接儀器,首先要檢查裝置的氣密性;用過氧化氫溶液制氧氣,用鋅和稀硫酸在常溫下制氫氣,反應物都是固體和液體,都不需要加熱,制CO2的裝置還可以用來制取氧氣或氫氣,反應的化學方程式分別為2H2O2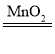 2H2O+O2↑(或Zn+H2SO4=ZnSO4+H2↑);用裝置A制氣體需要加熱,初中化學中通過加熱制氣體一般為用高錳酸鉀或氯酸鉀和二氧化錳裝置制氧氣,H是排水法收集氣體,氧氣不易溶于水,可用排水法收集,裝置A和裝置H連接可制取氧氣;
2H2O+O2↑(或Zn+H2SO4=ZnSO4+H2↑);用裝置A制氣體需要加熱,初中化學中通過加熱制氣體一般為用高錳酸鉀或氯酸鉀和二氧化錳裝置制氧氣,H是排水法收集氣體,氧氣不易溶于水,可用排水法收集,裝置A和裝置H連接可制取氧氣;
(2)二氧化碳能使石灰水變渾濁,二氧化碳一般用澄清的石灰水檢驗,氫氧化鈣與二氧化碳反應生成碳酸鈣和水,反應的化學方程式為:Ca(OH)2+CO2═CaCO3↓+H2O;
(3)通過比較可知:實驗③有平穩氣流產生,實驗室用于制取CO2的藥品最合理的是③,碳酸鈣和鹽酸生成氯化鈣和水和二氧化碳,反應的化學方程式為:CaCO3+2HCl═CaCl2+CO2↑+H2O;
(4)實驗室是用石灰石和稀鹽酸在常溫下來制取二氧化碳的,因此不需要加熱,二氧化碳用濃硫酸干燥,二氧化碳能溶于水,密度比空氣的密度大,因此只能用向上排空氣法收集,若要制取干燥的CO2,所有裝置的連接順序為:BCG;
(5)如果用濃鹽酸,揮發出的氯化氫氣體可以用水吸收,二氧化碳用濃硫酸干燥,用向上排空氣法收集,若不慎用濃鹽酸代替稀鹽酸制得了CO2氣體,要得到純凈干燥的CO2,所有裝置的連接順序為:BECG。


 優學名師名題系列答案
優學名師名題系列答案科目:初中化學 來源: 題型:
【題目】在學習了空氣中氧氣含量測定后,李老師給同學們布置了一道作業題:根據已有知識再設計幾套測定空氣中氧氣含量的裝置。以下是同學們設計的裝置中的三套。
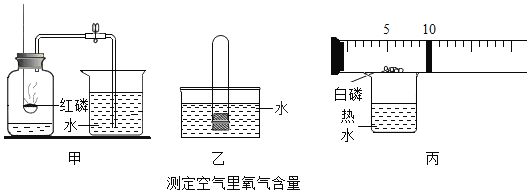
實驗甲:先將紅磷點燃后伸入集氣瓶,待裝置冷卻再打開止水夾;
實驗乙:先在試管中放入一團白磷,用橡皮塞塞緊后放入熱水中,使白磷燃燒,待裝置冷卻后將試管如圖乙倒立于水槽中,并在水下取下橡皮塞;
實驗丙:在一個帶有活塞和刻度的容器內放入一團白磷(白磷的著火點很低只有40度),置于盛有80度熱水的燒杯上方。
(1)從環保的角度分析,甲和乙哪一個裝置更好?__________。
(2)小麗同學按照丙裝置進行實驗,她觀察到白磷_________,活塞先往________(填“左”或“右”)移,最后活塞停留在_________刻度處。請寫出該實驗的文字表達式________________。
查看答案和解析>>
科目:初中化學 來源: 題型:
【題目】關于化學方程式2HgO![]() 2Hg+O2↑的理解和描述正確的是( )
2Hg+O2↑的理解和描述正確的是( )
A. 2份質量的氧化汞加熱分解生成2份質量的汞和1份質量的氧氣
B. 2個氧化汞分子加熱分解生成2個汞分子和一個氧分子
C. 此化學反應生成了兩種新微粒:汞原子和氧分子
D. 此化學反應中原子的種類和個數沒有改變
查看答案和解析>>
科目:初中化學 來源: 題型:
【題目】金屬和金屬材料在生產生活中有廣泛的用途。請回答下列問題:
(1)銅可以拉成銅絲,這是利用金屬銅的_____
(2)鐵制品銹蝕的過程,實際上是鐵跟空氣中的_____同時接觸發生化學反應的過程;工廠用稀硫酸除去鐵銹的原理是_____![]() 用化學方程式表示);為什么鋁比鐵更耐腐蝕_____
用化學方程式表示);為什么鋁比鐵更耐腐蝕_____
(3)鐵制品長期使用容易生銹,在鐵制品表面鍍鉻(Cr)可以防止鐵生銹,工業上獲取鍍鉻原料三氧化鉻的化學反應方程式為:Na2Cr2O7+X=2CrO3+Na2SO4+H2O,其中X的化學式為_____.
(4)將一定量的鋅粉加入到硝酸銀、硝酸銅的混合溶液中,充分反應后過濾,向濾渣中加入鹽酸無氣泡產生,則下列敘述中完全正確的是_____
①濾渣中一定含有銀,一定不含有銅
②濾液中的溶質一定含有硝酸鋅,一定不含有硝酸銀
③若濾液為藍色,則濾液中的溶質一定含有硝酸銅和硝酸鋅
④若濾液為無色,則濾渣中一定含有銀和銅,濾液中的溶質一定只含有硝酸鋅
查看答案和解析>>
科目:初中化學 來源: 題型:
【題目】根據下列實驗裝置圖,回答問題。
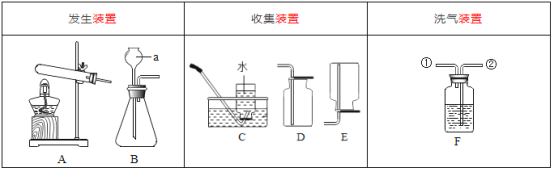
(1)寫出圖中儀器a的名稱:_____。
(2)實驗室用加熱氯酸鉀和二氧化錳混合物制取氧氣的化學方程式為____。
(3)實驗室用石灰石和稀鹽酸反應制取二氧化碳,該反應生成的二氧化碳氣體中常混有少量氯化氫氣體,可通過盛有飽和碳酸氫鈉溶液的F裝置除去氯化氫氣體,則該混合氣體應從F裝置的____(填“①”或“②”)通入。
查看答案和解析>>
科目:初中化學 來源: 題型:
【題目】在催化劑的作用下,用 O2 將 HCl 轉化成 Cl2,可提高效益,主要流程如圖,下列關于該原理說法正確的 是
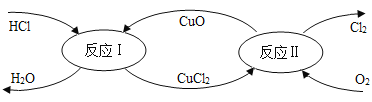
A. 反應Ⅰ是置換反應,反應Ⅱ是復分解反應
B. 需要不斷補充 CuO,該轉化才能持續進行
C. 該轉化可表示為:4HCl+O2 Cl2 +2H2O
Cl2 +2H2O
D. 理論上,每消耗 36.5gHCl 就會產生 71gCl2
查看答案和解析>>
科目:初中化學 來源: 題型:
【題目】水和溶液在生產、生活中起著十分重要的作用。
(1)近日,浙江大學研制出世界上最輕的材料“碳海綿”,它被預測可代替活性炭用于凈水,說明它具有較強的_____性;
(2)如圖1的實驗中,當試管1中氣體的體積為6mL時,試管2中的氣體體積約為_____mL,該實驗說明水是由_____組成的;
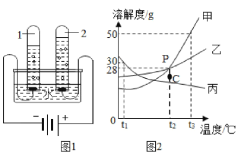
(3)欲使圖2中乙溶液的狀態從P點轉化為C點,可采取的措施是_____;
(4)圖2,t2℃時,把56克乙物質加入到200克水中充分攪拌,靜置,形成的是_____溶液(填“飽和”或“不飽和”);
(5)圖2,將t2℃時甲乙丙三種物質的飽和溶液降溫到t1℃,則t1℃時所得甲乙丙三種溶液溶質質量分數從大到小的順序為_____;
(6)圖2,將150克甲的飽和溶液從t3℃降到t2℃后,向其中加入50克水,所得溶液的溶質質量分數是_____(計算結果精確到0.1%)。
查看答案和解析>>
科目:初中化學 來源: 題型:
【題目】我市某地盛產石灰石,其中含有不溶于鹽酸的雜質.某化學興趣小組為了測定石灰石中碳酸鈣的含量,取10.0g石灰石樣品,經粉碎后全部放入燒杯中,并加入適量的稀鹽酸,使得稀鹽酸和碳酸鈣恰好反應。已知稱量初始時刻的燒杯及所盛物質(石灰石和稀鹽酸)的總質量為80.0g.(其中燒杯質量為62.8g)反應過程中測得燒杯及所盛物質的質量與相應時間記錄如下表:
反應時間/分 | 0 | 2 | 4 | 6 | 8 | 10 |
燒杯及所盛物質質量/克 | 80.0 | 79.0 | 78.3 | 77.9 | 77.8 | 77.8 |
試計算:(1)反應結束后,共放出_____克的二氧化碳?
(2)反應結束后得到的溶液的溶質質量分數是____?(結果保留到小數點后一位)
查看答案和解析>>
科目:初中化學 來源: 題型:
【題目】某化學興趣小組對氫氣的實驗室制法,進行了一系列實驗探究。
(1)小組用鋅與稀鹽酸反應制取氫氣,該反應的化學方程式為_____。
(2)為了加快鋅與稀鹽酸的反應速率,老師提示可向反應物中加入少量硫酸銅固體,為了弄明白速率加快的原因,小組同學提出了以下猜想。
(猜想與假設)甲同學:可能與硫酸根離子有關;
乙同學:可能與銅離子有關;
丙同學:可能與銅單質有關。丙同學猜想的依據是_____。
設計并進行實驗室溫時,小組同學按下表進行實驗,觀察并記錄現象。
實驗序號 | ① | ② | ③ | ④ |
實驗 |
|
|
|
|
產生氣泡的快慢 | 較快 | 明顯加快 | 較快 | 明顯加快 |
(分析并得出結論)
(3)由實驗①和實驗③發現反應速率幾乎沒有變化得出甲同學的猜想_____(選填“正確”或“不正確”)。
(4)實驗④是將硫酸銅換成氯化銅進一步驗證猜想,丙同學認為不需要替換試劑,只需通過觀察實驗②的現象就可以驗證,該反應的現象為_____。此反應發生后反應速率加快依然較明顯,小組同學得出_____的猜想正確。
(5)請你重新設計一個實驗方案驗證丙同學的猜想。實驗方案:_____。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com