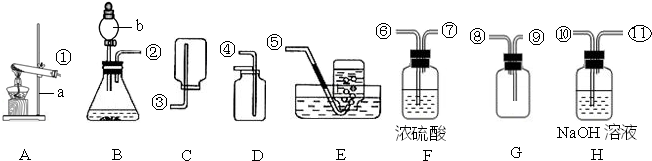
解:(1)實驗室用高錳酸鉀制取氧氣的反應物的狀態是固態,反應條件需要加熱,所以可選用的發生裝置是A;反應的方程式是:2KMnO
4
K
2MnO
4+MnO
2+O
2↑;
(2)產生的氣體中不含酸性雜質氣體,則使用的酸是稀硫酸,用G裝置收集氫氣,因氫氣的密度比空氣小,②應⑧連接,反應的化學方程式為:Zn+H
2SO
4=ZnSO
4+H
2↑;
(3)實驗室用Na
2SO
3固體與稀H
2SO
4在常溫下反應制取SO
2氣體,屬于固液在常溫下反應制取氣體,發生裝置選B;因制備并收集一瓶干燥的SO
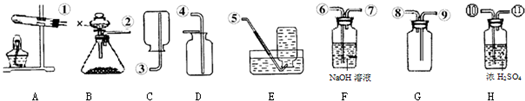
2氣體,因此在收集之前應將二氧化硫中的水蒸氣給除去,應選H裝置,氣體應從⑩進入;二氧化硫能溶于水,不能用排水法收集,二氧化硫的密度比空氣大,應用向上排空氣法收集,由因二氧化硫有毒,因而要用G裝置收集,也就是把空氣從上面的管口⑧排出,二氧化硫從下面的管口⑨進入;因二氧化硫有毒,為污染空氣應將其除去,應選F裝置,應從⑥進,總之導管的接口序號為②→⑩→
→⑨→⑧→⑥.
故答案為:(1)A;2KMnO
4
K
2MnO
4+MnO
2+O
2↑;
(2)稀硫酸;⑧;Zn+H
2SO
4=ZnSO
4+H
2↑;
(3)②→⑩→
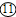
→⑨→⑧→⑥
分析:(1)根據實驗室用高錳酸鉀制取氧氣的反應物的狀態和反應條件選擇發生裝置;熟記反應原理;
(2)根據B裝置的特點分析,制備氫氣可以使用活潑金屬與稀硫酸或稀鹽酸反應;根據氫氣的密度比空氣小分析;
(3)根據制取二氧化硫氣體的反應物的狀態和反應條件分析發生裝置,根據二氧化硫的密度和溶解性選擇發生裝置,再結合綠色化學的理念分析.
點評:本題考查了氣體的實驗室制法,要熟練掌握反應原理、發生裝置的選擇、收集裝置的選擇;另外還要能增強根據題中給出的信息解決提出的問題的能力.

 K2MnO4+MnO2+O2↑;
K2MnO4+MnO2+O2↑;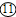 →⑨→⑧→⑥.
→⑨→⑧→⑥. K2MnO4+MnO2+O2↑;
K2MnO4+MnO2+O2↑;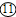 →⑨→⑧→⑥
→⑨→⑧→⑥




 →⑨→⑧→⑥
→⑨→⑧→⑥ →⑨→⑧→⑥
→⑨→⑧→⑥