
(3分)為了測定某產品中碳酸鋇的質量分數進行了如下實驗。取一定量的樣品和400g溶質質量分數為10%的稀鹽酸放入燒杯中。在化學反應過程中對燒杯及其中的剩余物進行了五次稱量,記錄如下表:(假設反應勻速進行;雜質不溶于水,也不與稀鹽酸反應,燒杯的質量為25.4g)
| 反應時間 | t1 | t2 | t3 | t4 | t5 |
| 燒杯和藥品質量/g | 516.6 | 507.8 | m | 503.4 | 503.4 |
(1)503.4g(2)98.5%;(3)23.6%
解析試題分析:(1)由題中的敘述反應為勻速進行,故每個時間段減少的質量應該相等,t1到t2減少的質量為516.6-507.8= 8.8g,到t4時也沒在減少8.8g,故在t3反應段碳酸鋇就反應完,故剩余質量為503.4g
(2)生成的二氧化碳的總質量為:516.6g-507.8g=8.8g, 507.8g-503.4g=4.4g, 8.8g+8.8g+4.4g=22g
解:設碳酸鋇的質量為x,消耗鹽酸的質量為y,產生氯化鋇的質量為z。
BaCO3 + 2HCl = BaCl2 + H2O + CO2↑
197 73 208 44
x y z 22g 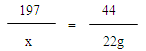
X=98.5g
503.4g+22g-25.4g-400g=100g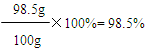
答:該產品中碳酸鋇的質量分數為98.5%。
(3)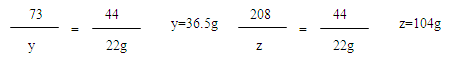
36.5g÷10%=365g
365g+98.5g-22g=441.5g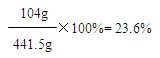
答:若產品中碳酸鋇與稀鹽酸恰好完全反應時,所得溶液中溶質的質量分數為23.6%。
考點:有關溶液的計算,化學方程式的計算


 教育世家狀元卷系列答案
教育世家狀元卷系列答案 黃岡課堂作業本系列答案
黃岡課堂作業本系列答案 單元加期末復習先鋒大考卷系列答案
單元加期末復習先鋒大考卷系列答案科目:初中化學 來源: 題型:計算題
為檢查某石灰石樣品中碳酸鈣的純度,取該樣品12g放入燒杯中,再向燒杯中加入35g稀鹽酸,恰好完全反應(雜質不參加反應),反應后燒杯中剩余固體物質共42.6 g,
(1)反應生成CO2的質量為 g;
(2)石灰石樣品中碳酸鈣的質量分數(結果保留至0.1%)
查看答案和解析>>
科目:初中化學 來源: 題型:計算題
(3分)為測定石灰石樣品中碳酸鈣的含量,小明取25 g石灰石樣品與一定質量的14.6%的稀鹽酸恰好完全反應,將反應所得混合物蒸干得到固體27.2 g(不含結晶水,假設樣品中的雜質既不與稀鹽酸反應)。試計算:
(1)參加反應的鹽酸的質量。
(2)石灰石樣品中碳酸鈣的含量。
查看答案和解析>>
科目:初中化學 來源: 題型:計算題
(3分)取含Na2CO3和NaCl的樣品34g放在燒杯中并加入稀鹽酸146g,恰好完全反應,此時,燒杯內溶液的總質量為175.6g。
計算:反應后所得溶液的溶質質量分數。
查看答案和解析>>
科目:初中化學 來源: 題型:計算題
某興趣小組同學在一次實驗中偶然發現:向盛有一定量鐵粉的燒杯中加入稀硫酸有氣泡產生,迅速加入一定量的氧化銅,攪拌,不再產生氣泡、黑色粉末中逐漸出現紅色固體后又有氣泡產生。請回答:
① 若實驗過程中共收集到0.1 g氫氣,求生成0.1 g氫氣所消耗的硫酸的物質的量。
② 加入氧化銅后,不產生氣泡的原因是 (11) (用化學方程式表示)。
③ 充分反應后過濾,為確定濾液中的溶質成分,在濾液樣品中插入一根鐵絲,可能出現的現象和結論如下。
| 現象 | 結論 |
| (12) | 濾液中的溶質是FeSO4 |
| 有紅色固體析出 | 濾液中的溶質可能有哪幾種情況? (13) |
| (14) | 濾液中的溶質是 (15) |
查看答案和解析>>
科目:初中化學 來源: 題型:計算題
雞蛋殼的主要成分是碳酸鈣,某興趣小組為了測定雞蛋殼中CaCO3的含量,現取15g雞蛋殼,搗碎,放在燒杯中,然后向其中加入80g某濃度的稀鹽酸,使之充分反應(雞蛋殼中除CaCO3外的其他成分都不溶于水,且不與稀鹽酸反應),測得燒杯中的反應剩余物的質量(m)與反應時間(t)的關系如圖所示(忽略水蒸氣的揮發),其中當反應進行到B點時,所用鹽酸剛好消耗了加入量的一半,試計算(計算結果保留1位小數)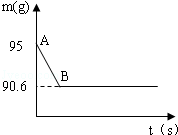
(1)產生CO2的質量為 g;
(2)該雞蛋殼中CaCO3的質量分數;
(3)所用稀鹽酸中溶質的質量分數;
查看答案和解析>>
科目:初中化學 來源: 題型:計算題
我們的日常生活離不開食鹽,食鹽的主要成分是氯化鈉,某同學想測定配制的氯化鈉溶液的溶質質量分數。取100g氯化鈉溶液,加入足量的硝酸銀溶液,生成14.35g沉淀。試計算硝酸銀溶液中溶質質量分數。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com