
小亮同學想通過實驗探究某企業(yè)采用的氨堿法制的的純堿樣品的成分及含量。
【提出問題】該純堿樣品中含有哪些物質(zhì)?
【猜想與假設】通過分析,小亮做出如下假設:
(1)只含有Na2CO3 ; (2)含有Na2CO3和NaHCO3
【查閱資料】
|
|
NaHCO3 |
Na2CO3 |
|
加入稀鹽酸 |
現(xiàn)象Ⅰ |
產(chǎn)生氣泡 |
|
加入飽和石灰水 |
溶液變渾濁 |
現(xiàn)象Ⅱ |
|
加入CaCl2溶液 |
無明顯現(xiàn)象 |
溶液變渾濁 |
|
加熱溶液至沸騰,將氣體通入澄清石灰水 |
澄清石灰水變渾濁 |
澄清石灰水無明顯變化 |
(1)表中的現(xiàn)象Ⅰ為 ;
(2)現(xiàn)象Ⅱ?qū)幕瘜W方程式為 。
【實驗探究】為了確定純堿樣品的成分,小亮設計如下實驗方案,請你一起完成小列實驗報告。
|
實驗步驟 |
實驗現(xiàn)象 |
|
|
①取少量樣品溶于水,加入過量的CaCl2溶液。 |
; |
該反應的方程式: 。 |
|
②將上述反應后的混合液過濾,取濾液 。 |
; |
證明猜想②成立。 |
【實驗反思】
實驗步驟①中,氯化鈣溶液過量的目的是 。
【提出問題2】如何測量該純堿樣品中各物質(zhì)的含量?
(1)為測量該純堿樣品各成分的含量,小亮設計了下圖裝置,通過稱量B裝置懂得質(zhì)量變化來確定樣品中各成分的含量。該裝置氣密性良好,稀硫酸與樣品、進入裝置B的CO2與NaOH均完全反應,操作無誤,但多次實驗發(fā)現(xiàn),測定結(jié)果有偏差。造成偏差的原因有
 ①
;
①
;
② 。
(2)小亮在老師的指導下重新設計了如下的實驗裝置。該實驗有以下操作步驟:

①檢查裝置氣密性,將w g 干燥的樣品放入錐形瓶中;
②稱量盛有氫氧化鈉濃溶液的B瓶質(zhì)量;
③打開活塞b,從導管a處緩緩鼓入一定量的空氣,關閉活塞b;
④向錐形瓶中逐滴加入稀硫酸至不再產(chǎn)生氣泡
⑤再次稱量盛有氫氧化鈉濃溶液的B瓶質(zhì)量;
⑥打開活塞b,從導管a處緩緩鼓入一定量的空氣,關閉活塞b;
⑦根據(jù)B瓶增加的質(zhì)量,計算樣品中各成分的含量。
該實驗的正確步驟是 。
【查閱資料】(1)產(chǎn)生氣泡(1分)
(2)Ca(OH)2 + Na2CO3 = CaCO3↓+ 2NaOH(1分)
【實驗探究】
|
實驗操作 |
實驗現(xiàn)象 |
實驗結(jié)論 |
|
|
有白色沉淀生成(1分) |
Na2CO3 + CaCl2 =CaCO3↓+ 2NaCl(1分) |
|
滴加稀鹽酸(或加入澄清石灰水;或加熱至沸騰,將氣體通入澄清石灰水,1分) |
有氣泡產(chǎn)生(或溶液變渾濁,1分) |
|
【實驗反思】除盡樣品溶液中的Na2CO3(或避免干擾NaHCO3的檢驗,1分)
【提出問題2】(1)①空氣中的CO2進入裝置B被氫氧化鈉吸收(1分)
②裝置A中殘留的CO2未被裝置B中的氫氧化鈉吸收(1分)
(2)①③②④⑥⑤⑦(1分)
【解析】碳酸氫鈉與鹽酸反應也生成二氧化碳,所以實驗現(xiàn)象為有氣泡產(chǎn)生,碳酸鈉與氫氧化鈣反應生成碳酸鈣和氫氧化鈉,純堿樣品中含有碳酸鈉,所以能與氯化鈣反應生成難溶性的碳酸鈣,現(xiàn)象為有白色沉淀生成,碳酸鈉與氯化鈣反應生成碳酸鈣和氯化鈉,猜想②成立,說明固體中有碳酸氫鈉,即上述反應完成后濾液的溶質(zhì)為碳酸氫鈉、氯化鈉和氯化鈣,根據(jù)資料可知,可利用稀鹽酸或氫氧化鈣溶液檢驗碳酸氫鈉的存在,或?qū)⑷芤杭訜幔锰妓釟溻c受熱分解產(chǎn)生二氧化碳進行檢驗,步驟①中加入過量的氯化鈣是使碳酸鈉全部轉(zhuǎn)化為碳酸鈣,不影響碳酸氫鈉的檢驗,對比改進前后實驗,小亮方案中引起誤差的原因一是空氣中的二氧化碳也會被氫氧化鈉溶液吸收,二是反應產(chǎn)生的二氧化碳無法被氫氧化鈉溶液完全吸收;利用改進后裝置進行純度測定的操作,由于實驗中需測定氣體的質(zhì)量,所以必需先檢查裝置的氣密性,然后再加入一定量的樣品,然后通過入除去二氧化碳后的空氣將裝置中的空氣排出,充分吸收其中的二氧化碳,再黍量B的質(zhì)量,然后加入稀硫酸與樣品反應,反應結(jié)束后,再通入除去二氧化碳的空氣,將裝置中的二氧化碳全部排出,全部被氫氧化鈉溶液吸收,然后現(xiàn)次稱量B的質(zhì)量,根據(jù)B裝置質(zhì)量變化確定反應產(chǎn)生二氧化碳的質(zhì)量,求出樣品中各成分的質(zhì)量。


 提分百分百檢測卷單元期末測試卷系列答案
提分百分百檢測卷單元期末測試卷系列答案科目:初中化學 來源: 題型:閱讀理解
| NaHCO3 | Na2CO3 | |
| 加入稀鹽酸 | 現(xiàn)象Ⅰ | 產(chǎn)生氣泡 |
| 加入飽和石灰水 | 溶液變渾濁 | 現(xiàn)象Ⅱ |
| 加入CaCl2溶液 | 無明顯現(xiàn)象 | 溶液變渾濁 |
| 加熱溶液至沸騰,將氣體通入澄清石灰水 | 澄清石灰水變渾濁 | 澄清石灰水無明顯變化 |
| 實驗步驟 | 實驗現(xiàn)象 | |
| ①取少量樣品溶于水,加入過量的CaCl2溶液. | 有白色沉淀產(chǎn)生 有白色沉淀產(chǎn)生 ; |
該反應的方程式: Na2CO3+CaCl2═CaCO3↓+2NaCl Na2CO3+CaCl2═CaCO3↓+2NaCl . |
| ②將上述反應后的混合液過濾,取濾液 滴加稀鹽酸 滴加稀鹽酸 . |
有氣泡冒出 有氣泡冒出 ; |
證明猜想②成立. |
查看答案和解析>>
科目:初中化學 來源: 題型:閱讀理解
小亮同學想通過實驗探究某企業(yè)采用的氨堿法制的的純堿樣品的成分及含量。
【提出問題】該純堿樣品中含有哪些物質(zhì)?
【猜想與假設】通過分析,小亮做出如下假設:
(1)只含有Na2CO3 ; (2)含有Na2CO3和NaHCO3
【查閱資料】
| NaHCO3 | Na2CO3 | |
| 加入稀鹽酸 | 現(xiàn)象Ⅰ | 產(chǎn)生氣泡 |
| 加入飽和石灰水 | 溶液變渾濁 | 現(xiàn)象Ⅱ |
| 加入CaCl2溶液 | 無明顯現(xiàn)象 | 溶液變渾濁 |
| 加熱溶液至沸騰,將氣體通入澄清石灰水 | 澄清石灰水變渾濁 | 澄清石灰水無明顯變化 |
(1)表中的現(xiàn)象Ⅰ為 ;
(2)現(xiàn)象Ⅱ?qū)幕瘜W方程式為 。
【實驗探究】為了確定純堿樣品的成分,小亮設計如下實驗方案,請你一起完成小列實驗報告。
| 實驗步驟 | 實驗現(xiàn)象 | |
| ①取少量樣品溶于水,加入過量的CaCl2溶液。 | ; | 該反應的方程式: 。 |
| ②將上述反應后的混合液過濾,取濾 。 | ; | 證明猜想②成立。 |
【實驗反思】
實驗步驟①中,氯化鈣溶液過量的目的是 。
 【提出問題2】如何測量該純堿樣品中各物質(zhì)的含量?
【提出問題2】如何測量該純堿樣品中各物質(zhì)的含量?
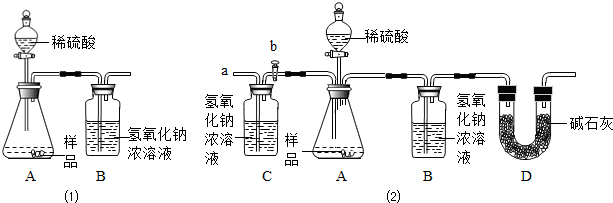
(1)為測量該純堿樣品各成分的含量,小亮設計了右圖裝置,通過稱量B裝置懂得質(zhì)量變化來確定樣品中各成分的含量。該裝置氣密性良好,稀硫酸與樣品、進入裝置B的CO2與NaOH均完全反應,操作無誤,但多次實驗發(fā)現(xiàn),測定結(jié)果有偏差。造成偏差的原因有① ;
② 。
(2)小亮在老師的指導下重新設計了如下的實驗裝置。該實驗有以下操作步驟:
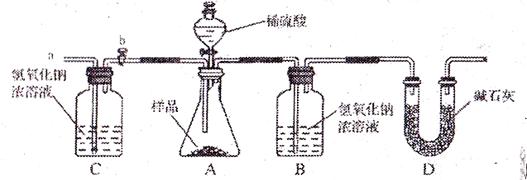
①檢查裝置氣密性,將w g 干燥的樣品放入錐形瓶中;
②稱量盛有氫氧化鈉濃溶液的B瓶質(zhì)量;
③打開活塞b,從導管a處緩緩鼓入一定量的空氣,關閉活塞b;
④向錐形瓶中逐滴加入稀硫酸至不再產(chǎn)生氣泡
⑤再次稱量盛有氫氧化鈉濃溶液的B瓶質(zhì)量;
⑥打開活塞b,從導管a處緩緩鼓入一定量的空氣,關閉活塞b;
⑦根據(jù)B瓶增加的質(zhì)量,計算樣品中各成分的含量。
該實驗的正確步驟是 。
查看答案和解析>>
科目:初中化學 來源:2013年山東省泰安市中考化學試卷(解析版) 題型:填空題
| NaHCO3 | Na2CO3 | |
| 加入稀鹽酸 | 現(xiàn)象Ⅰ | 產(chǎn)生氣泡 |
| 加入飽和石灰水 | 溶液變渾濁 | 現(xiàn)象Ⅱ |
| 加入CaCl2溶液 | 無明顯現(xiàn)象 | 溶液變渾濁 |
| 加熱溶液至沸騰,將氣體通入澄清石灰水 | 澄清石灰水變渾濁 | 澄清石灰水無明顯變化 |
| 實驗步驟 | 實驗現(xiàn)象 | |
| ①取少量樣品溶于水,加入過量的CaCl2溶液. | ; | 該反應的方程式: . |
| ②將上述反應后的混合液過濾,取濾液 . | ; | 證明猜想②成立. |

查看答案和解析>>
科目:初中化學 來源: 題型:閱讀理解
小亮同學想通過實驗探究某企業(yè)采用的氨堿法制的的純堿樣品的成分及含量。
【提出問題】該純堿樣品中含有哪些物質(zhì)?
【猜想與假設】通過分析,小亮做出如下假設:
(1)只含有Na2CO3 ; (2)含有Na2CO3和NaHCO3
【查閱資料】
| NaHCO3 | Na2CO3 | |
| 加入稀鹽酸 | 現(xiàn)象Ⅰ | 產(chǎn)生氣泡 |
| 加入飽和石灰水 | 溶液變渾濁 | 現(xiàn)象Ⅱ |
| 加入CaCl2溶液 | 無明顯現(xiàn)象 | 溶液變渾濁 |
| 加熱溶液至沸騰,將氣體通入澄清石灰水 | 澄清石灰水變渾濁 | 澄清石灰水無明顯變化 |
(1)表中的現(xiàn)象Ⅰ為 ;
(2)現(xiàn)象Ⅱ?qū)幕瘜W方程式為 。
【實驗探究】為了確定純堿樣品的成分,小亮設計如下實驗方案,請你一起完成小列實驗報告。
| 實驗步驟 | 實驗現(xiàn)象 | |
| ①取少量樣品溶于水,加入過量的CaCl2溶液。 | ; | 該反應的方程式: 。 |
| ②將上述反應后的混合液過濾,取濾液 。 | ; | 證明猜想②成立。 |
【實驗反思】
實驗步驟①中,氯化鈣溶液過量的目的是 。
 【提出問題2】如何測量該純堿樣品中各物質(zhì)的含量?
【提出問題2】如何測量該純堿樣品中各物質(zhì)的含量?
(1)為測量該純堿樣品各成分的含量,小亮設計了右圖裝置,通過稱量B裝置懂得質(zhì)量變化來確定樣品中各成分的含量。該裝置氣密性良好,稀硫酸與樣品、進入裝置B的CO2與NaOH均完全反應,操作無誤,但多次實驗發(fā)現(xiàn),測定結(jié)果有偏差。造成偏差的原因有① ;
② 。
(2)小亮在老師的指導下重新設計了如下的實驗裝置。該實驗有以下操作步驟:

①檢查裝置氣密性,將w g 干燥的樣品放入錐形瓶中;
②稱量盛有氫氧化鈉濃溶液的B瓶質(zhì)量;
③打開活塞b,從導管a處緩緩鼓入一定量的空氣,關閉活塞b;
④向錐形瓶中逐滴加入稀硫酸至不再產(chǎn)生氣泡
⑤再次稱量盛有氫氧化鈉濃溶液的B瓶質(zhì)量;
⑥打開活塞b,從導管a處緩緩鼓入一定量的空氣,關閉活塞b;
⑦根據(jù)B瓶增加的質(zhì)量,計算樣品中各成分的含量。
該實驗的正確步驟是 。
查看答案和解析>>
國際學校優(yōu)選 - 練習冊列表 - 試題列表
湖北省互聯(lián)網(wǎng)違法和不良信息舉報平臺 | 網(wǎng)上有害信息舉報專區(qū) | 電信詐騙舉報專區(qū) | 涉歷史虛無主義有害信息舉報專區(qū) | 涉企侵權舉報專區(qū)
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com