(2012?揚(yáng)中市模擬)我國(guó)化工專家侯德榜的“侯氏制堿法”曾為世界制堿工業(yè)做出了突出貢獻(xiàn).他以NaCl、NH
3、CO
2等為原料先制得NaHCO
3,進(jìn)而生產(chǎn)出純堿.有關(guān)反應(yīng)的化學(xué)方程式為:
NH
3+CO
2+H
2O═NH
4HCO
3;
NH
4HCO
3+NaCl═NaHCO
3↓+NH
4Cl;
2NaHCO
3Na
2CO
3+CO
2↑+H
2O
回答下列問(wèn)題:
(1)碳酸氫銨與飽和食鹽水反應(yīng),能析出碳酸氫鈉晶體的原因是
c
c
(填字母標(biāo)號(hào)).
a.碳酸氫鈉難溶于水 b.碳酸氫鈉受熱易分解 c.碳酸氫鈉的溶解度相對(duì)較小,所以在溶液中首先結(jié)晶析出
(2)某探究活動(dòng)小組根據(jù)上述制堿原理,進(jìn)行碳酸氫鈉的制備實(shí)驗(yàn),同學(xué)們按各自設(shè)計(jì)的方案實(shí)驗(yàn).
①一位同學(xué)將二氧化碳?xì)怏w通入含氨的飽和食鹽水中制備碳酸氫鈉,實(shí)驗(yàn)裝置如下圖所示(圖中夾持、固定用的儀器未畫出).
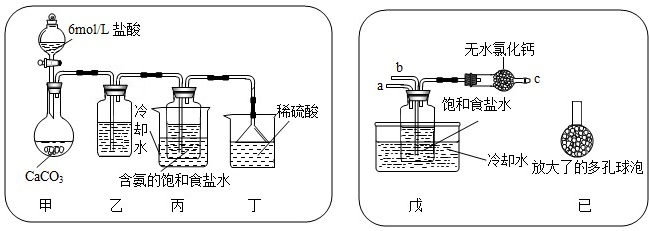
試回答下列有關(guān)問(wèn)題:
(Ⅰ)乙裝置中的試劑是 飽和的碳酸氫鈉溶液,作用是
吸收甲裝置可能揮發(fā)出的氯化氫氣體
吸收甲裝置可能揮發(fā)出的氯化氫氣體
;
(Ⅱ)丁裝置中稀硫酸的作用是
吸收末反應(yīng)的NH3
吸收末反應(yīng)的NH3
;
(Ⅲ)實(shí)驗(yàn)結(jié)束后,分離出NaHCO
3晶體的操作是
過(guò)濾
過(guò)濾
(填分離操作的名稱).
②另一位同學(xué)用圖中戊裝置(其它裝置未畫出)進(jìn)行實(shí)驗(yàn).
(Ⅰ)實(shí)驗(yàn)時(shí),須先從
a
a
管通入
氨氣
氨氣
氣體;
(Ⅱ)有同學(xué)建議在戊裝置的b管下端連接己裝置,理由是
增大氣體與溶液接觸面積,提高CO2吸收率
增大氣體與溶液接觸面積,提高CO2吸收率
;
(3)請(qǐng)你再寫出一種實(shí)驗(yàn)室制取少量碳酸氫鈉的方法:
用碳酸氫銨與適量飽和食鹽水反應(yīng).(或往燒堿溶液中通入過(guò)量CO2;往飽和Na2CO3 溶液中通入過(guò)量CO2 等.其他合理方法均可)
用碳酸氫銨與適量飽和食鹽水反應(yīng).(或往燒堿溶液中通入過(guò)量CO2;往飽和Na2CO3 溶液中通入過(guò)量CO2 等.其他合理方法均可)
.
(4)“純堿中常常會(huì)混有少量氯化鈉.”某研究性學(xué)習(xí)小組以一包純堿(只考慮含氯化鈉)為研究對(duì)象,探究純堿樣品中碳酸鈉的含量.
【實(shí)驗(yàn)設(shè)計(jì)】
甲方案
Ⅰ.設(shè)計(jì)思路:根據(jù)樣品與氯化鈣溶液反應(yīng)生成沉淀碳酸鈣的質(zhì)量,求出碳酸鈉的質(zhì)量,再計(jì)算樣品中碳酸鈉的質(zhì)量分?jǐn)?shù).
Ⅱ.操作步驟:稱取13.25g純堿樣品,加入過(guò)量的氯化鈣溶液,充分?jǐn)嚢瑁^(guò)濾、洗滌、干燥,得到的白色沉淀10.00g.
Ⅲ.?dāng)?shù)據(jù)處理:請(qǐng)根據(jù)上述實(shí)驗(yàn)數(shù)據(jù),計(jì)算該樣品中碳酸鈉的質(zhì)量分?jǐn)?shù).
計(jì)算過(guò)程:
解:設(shè)純堿樣品中含Na
2CO
3的質(zhì)量為x
Na
2CO
3+CaCl
2═CaCO
3↓+2NaCl
106 100
x 10.00g
=x=10.6g
純堿樣品中Na
2CO
3的質(zhì)量分?jǐn)?shù)為
×100%=80%
解:設(shè)純堿樣品中含Na
2CO
3的質(zhì)量為x
Na
2CO
3+CaCl
2═CaCO
3↓+2NaCl
106 100
x 10.00g
=x=10.6g
純堿樣品中Na
2CO
3的質(zhì)量分?jǐn)?shù)為
×100%=80%
乙方案
I.設(shè)計(jì)思路:根據(jù)樣品(質(zhì)量為a g)與稀硫酸完全反應(yīng)生成二氧化碳的質(zhì)量(質(zhì)量為b g),求出碳酸鈉的質(zhì)量,再計(jì)算樣品中碳酸鈉的質(zhì)量分?jǐn)?shù).
II.實(shí)驗(yàn)結(jié)論:
(1)當(dāng)a、b的質(zhì)量關(guān)系滿足
(填寫含a、b字母的表達(dá)式,下同)時(shí),純堿樣品中只含有碳酸鈉,樣品中碳酸鈉的質(zhì)量分?jǐn)?shù)是100%.
(2)當(dāng)a、b的質(zhì)量關(guān)系滿足
時(shí),純堿樣品室有碳酸鈉和少量氯化鈉組成的混合物,樣品中碳酸鈉的質(zhì)量分?jǐn)?shù)是
.
【實(shí)驗(yàn)評(píng)價(jià)】
誤差分析:
(一)甲方案中,白色沉淀的質(zhì)量在過(guò)濾、干燥等操作過(guò)程中會(huì)有所損耗,造成計(jì)算結(jié)果與實(shí)際值相比偏小.如果將氯化鈣溶液換成氯化鋇溶液,則可以使誤差減小,理由是
BaCl2比CaCl2的相對(duì)分子質(zhì)量大,產(chǎn)生的沉淀質(zhì)量大,稱量誤差小
BaCl2比CaCl2的相對(duì)分子質(zhì)量大,產(chǎn)生的沉淀質(zhì)量大,稱量誤差小
.
(二)乙方案中,有部分生成的二氧化碳?xì)怏w因溶解于水而沒(méi)有全部逸出,造成計(jì)算結(jié)果與實(shí)際值相比
偏小
偏小
(填“偏大”、“偏小”、或“不變”).



 計(jì)算高手系列答案
計(jì)算高手系列答案

 Na2CO3+CO2↑+H2O
Na2CO3+CO2↑+H2O