碳酸鉀 (K
2CO
3) 和硝酸鉀 (KNO
3) 在不同溫度時的溶解度及其溶解度曲線如表及圖1所示:
| 溫度/℃ |
20 |
30 |
50 |
60 |
80 |
溶解度
g/100g水 |
K2CO3 |
110 |
114 |
121 |
126 |
139 |
| KNO3 |
31.6 |
45.8 |
85.5 |
110 |
169 |
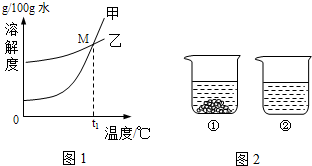
①30℃時K
2CO
3的溶解度為
g/100g水.
②圖1中能表示KNO
3溶解曲線的是
(填“甲”或“乙”).
③曲線上M點的含義是
.
④要配制100g 10%的KNO
3溶液,需要KNO
3固體
g.溶液配制過程中,除用到玻璃棒、膠頭滴管外,
還需用到下 列儀器中的
.(填字母編號)
A.電子天平 B.燒杯 C.漏斗 D.量筒
⑤60℃時500g飽和KNO
3溶液蒸發10g水后,再降溫到60℃,可析出KNO
3晶體
g.
⑥40℃時,向兩個分別盛有相同質量的硝酸鉀和碳酸鉀的燒杯中,各加入100g水,充分溶解后,恢復至40℃,其結果如圖2所示.下列有關說法中,正確的有
.(填字母編號)
A.燒杯①中溶解的是KNO
3,燒杯②中溶解的是K
2CO
3B.燒杯②中溶液是不飽和溶液
C.升高溫度或增加溶劑都有可能將燒杯①中固體全部溶解
D.若將燒杯①中的溶液變為不飽和溶液,溶液中溶質質量分數一定減小.



