
【題目】在一定溫度和壓強下的氣體,影響其所占體積大小的主要因素是
A.分子直徑的大小B.分子間距離的大小
C.分子數目的多少D.分子間引力的大小
科目:高中化學 來源: 題型:
【題目】某研究性學習小組討論甲、乙、丙、丁四種儀器裝置的有關用法,其中不合理的是( ) 
A.甲裝置:可用來證明碳的非金屬性比硅強
B.乙裝置:橡皮管的作用是能使水順利流下
C.丙裝置:用圖示的方法不能檢查此裝置的氣密性
D.丁裝置:先從①口進氣集滿二氧化碳,再從②口進氣,可收集一氧化氮
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】Ⅰ.(1)把一塊純凈的鋅片插入盛有稀硫酸的燒杯中,可觀察到鋅片逐漸溶解,并有氣泡產生;平行地插入一塊銅片(如圖甲裝置所示),可觀察到銅片上________(填“有”或“沒有”)氣泡產生;若用導線把鋅片和銅片連接起來(如圖乙裝置所示),可觀察到銅片上________(填“有”或“沒有”)氣泡產生。
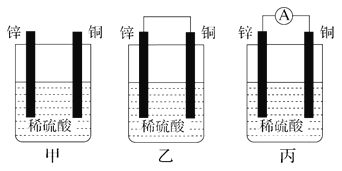
(2)用導線將電流表的兩端與溶液中的鋅片和銅片相連(如圖丙裝置所示),觀察到電流表的指針發生了偏轉,說明導線中有電流通過。鋅片上的電極反應:______________;銅片上的電極反應:____________________________。
(3)乙、丙裝置是將________能轉化為________能的裝置。
Ⅱ.斷開1molH﹣H鍵,1molN﹣H鍵,1molN≡N鍵分別需要吸收的能量為436kJ、391kJ、946kJ,求:
(1)1molN2生成NH3需_____(填“吸收”或“放出”)能量_____ kJ
(2)1molH2生成NH3需_____(填“吸收”或“放出”)能量_____ kJ(不考慮可逆反應)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】成都市近年來常常發生“毒奶粉”事件.劣質奶粉制造商為牟取暴利,大大降低了奶粉中蛋白質的含量,導致食用這種奶粉的眾多嬰幼兒嚴重營養不良乃至死亡.為了測定某牛奶樣品中蛋白質的含量,現采用“蓋爾達法”分解其中的蛋白質.其原理是把蛋白質中的氮元素完全轉化為氨氣(化學式為NH3),再用稀硫酸吸收氨氣,反應的化學方程式為:2NH3+H2SO4=(NH4)2 SO4現取該奶粉樣品100g,用“蓋爾達法”分解其中的蛋白質,產生的氨氣用7.5g溶質質量分數為19.6%的稀硫酸恰好完全吸收. 計算并回答下列問題:
(1)產生氨氣的質量是多少?(計算結果精確到0.01,下同)
(2)含氮元素的質量多少?
(3)該奶粉中氮的含量是否達到了國家規定的標準.(奶粉中蛋白質的含量國家標準為:每100g嬰幼兒奶粉中含12g~25g.蛋白質含氮元素的質量分數為16%)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】將9.6g銅單質置于200mL一定濃度的稀硝酸中,兩者恰好完全反應.假定溶液體積不變,請回答下列問題:(要求寫出計算過程) 
(1)反應生成的氣體的體積(標況下);
(2)反應過程中轉移電子的物質的量;
(3)參加反應的稀硝酸的物質的量濃度.
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】為倡導“節能減排”和“低碳經濟”,目前工業上有一種方法是用CO2來生產燃料乙醇。一定條件下發生反應:2CO2(g)+6H2(g)![]() CH3CH2OH(g)+3H2O(g) ΔH<0。
CH3CH2OH(g)+3H2O(g) ΔH<0。
(1)在一定條件下,在20 L密閉容器中按物質的量比為1∶3充入CO2和H2,溫度在450 K,n(H2)隨時間變化如表所示:
t/min | 0 | 1 | 3 | 5 |
n(H2)/mol | 8 | 6 | 5 | 5 |
在450 ℃、0~1 min,v(CH3CH2OH)=________;此溫度下該反應的化學平衡常數為________(結果保留三位有效數字)。
(2)在5 MPa下測得平衡體系中各物質的體積分數隨溫度的變化曲線如圖所示:

曲線乙表示的是 ________(填物質的化學式)的體積分數,圖像中A點對應的體積分數b=________%(結果保留三位有效數字)。
(3)下列措施中能使化學平衡向正反應方向移動的是________。
A.升高溫度
B.將CH3CH2OH(g)及時液化抽出
C.選擇高效催化劑
D.再充入l mol CO2和3 mol H2
(4)25 ℃、1.01×105Pa時,9.2 g液態乙醇完全燃燒,當恢復到原狀態時,放出273.4 kJ的熱量,寫出表示乙醇燃燒的熱化學方程式:________________________。
(5)以石墨為電極,氫氧化鈉、乙醇、水、氧氣為原料,可以制成乙醇的燃料電池,寫出發生還原反應的電極反應式:_____________________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】根據題意解答
(1)圖1是1molNO2和1molCO反應生成CO2和NO過程中能量變化示意圖,請寫出NO2和CO反應的熱化學方程式: . 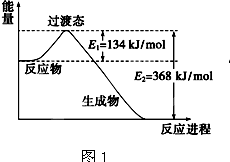
(2)觀察圖2a和b,根據蓋斯定律,寫出△H1、△H2、△H3、△H4、△H5和△H6的關系. 圖a:;
圖b: . 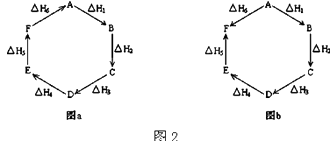
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知在稀溶液中,強酸跟強堿發生中和反應生成1mol水時的反應熱叫做中和熱。現利用如圖裝置進行中和熱的測定,請回答下列問題:
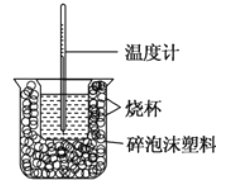
(1)圖中缺少的儀器或用品有______、______。
(2)做一次完整的中和熱測定實驗,溫度計需使用_____次。
(3)把溫度為15.0℃,濃度為0.5mol/L的酸溶液和0.55mol/L的堿溶液各50mL混合(溶液密度均為1g/mL),生成溶液的比熱容c=4.18 J·g-1·℃-1,輕輕攪動,測得酸堿混合液的溫度變化數據如下:
反應物 | 起始溫度t1/℃ | 終止溫度t2/℃ | 中和熱 |
HCl+NaOH | 15.0 | 18.3 | △H1 |
HCl+NH3·H2O | 15.0 | 18.0 | △H2 |
①計算表格中第一組實驗測出的中和熱△H1=______(保留一位小數)。
②寫出表格中第二組實驗的熱化學方程式:_______________(保留一位小數)。
③兩組實驗結果差異的原因是________________。
④堿溶液過量的原因是___________。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com