
【題目】反應SO2+O2=2SO3在密閉容器中進行。下列關于該反應的說法正確的是
A. 增大壓強能減慢反應速率
B. v(SO2):v(O2)=2:1證明該反應已達到化學平衡狀態
C. 當反應物和生成物濃度不變時,反應已達平衡
D. 增大02的濃度可使SO2完全轉化
 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源: 題型:
【題目】稀土有工業“黃金”之稱,我國稀土資源豐富。目前從氟碳鈰礦(主要化學成分為CeFCO3)提取鈰族稀土元素的冶煉處理工藝已經發展到十幾種,其中一種提取鈰的工藝流程如下:

已知:①焙燒后燒渣中含+4價的鈰及+3價的其它稀土氟氧化物:
②Ce4+能與SO42-結合成CeSO4,Ce4+能被萃取劑[(HA)2]萃取。
請回答下列問題:
(1)CeFCO3中,Ce元素的化合價為_____。
(2)“酸浸I”過程中CeO2轉化為Ce3+,且產生黃綠色氣體,用稀硫酸和H2O2,替換HCl就不會造成環境污染。則稀硫酸.H2O2與CeO2反應的離子方程式為:__________。
(3)“沉淀”步驟中發生的反應為:Ce(BF4)3(s)+3KCl(aq)=3KBF4(s)+CeCl3(aq)。已知Ce(BF4)3、KBF4的Ksp分別為a、b,則該反應的平衡常數為______(用含a、b的代數式表示)。
(4)“浸出液”中含有少量Ce4+及其他稀土元素的離子,可以通過“萃取”與“反萃取尋探作進一步分離、富集各離子。“萃取”時Ce4+與萃取劑[(HA)2]存在的反應為:Ce4++n(HA)2![]() Ce(H2a-4A2a)+4H+。用D表示Ce4+分別在有機層中與水層中存在形式的濃度之比(D=
Ce(H2a-4A2a)+4H+。用D表示Ce4+分別在有機層中與水層中存在形式的濃度之比(D=![]() )其它條件不變,在浸出液中加入不同量的NaSO4以改變水層中的c(SO42-),D隨浸出液中c(SO42-)增大而減小的原因是__________。
)其它條件不變,在浸出液中加入不同量的NaSO4以改變水層中的c(SO42-),D隨浸出液中c(SO42-)增大而減小的原因是__________。
(5)“操作I”后,向溶液中加入NaOH溶液,調節溶液的pH可獲得Ce(OH)3沉淀,當溶液中離子濃度小于1.0×10-6mol/L視為沉淀完全,常溫下加入NaOH調節溶液的pH應大于_______[已知:Ce(OH)3的Ksp=8.0×10-21;1g2=-0.3]
(6)寫出“氧化”步驟的化學方程式:_______________。
(7)CeO2是汽車尾氣凈化催化劑的關鍵成分,它能在還原氣氛中供氧,在氧化氣氛中耗氧在尾氣消除過程中發生著CeO2![]() CeO2(1-x) +xO2↑(0≤x≤0.25)的循環。寫出CeO2消除CO尾氣的化學方程式:________________。
CeO2(1-x) +xO2↑(0≤x≤0.25)的循環。寫出CeO2消除CO尾氣的化學方程式:________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】由芳香烴X合成一種功能高分子H的過程如下。(部分產物、合成路線、反應條件略去)。
其中A是一氯代物,H的鏈節組成為C7H5NO
已知:I芳香烴X用質譜儀測出的質譜圖如圖所示
請根據所學知識與本題所給信息回答下列問題
(1)H的結構簡式是_____________;(2)反應③和④的類型分別是_____________、_____________
(3)反應⑤的化學方程式是__________________________
(4)阿司匹林中含氧官能團的名稱為__________________________
(5) 的一種同系物
的一種同系物 有多種同分異構體,其中符合下列要求的共有_____________種(不考慮立體異構),寫出其中核磁共振氫譜為6組峰,且峰面積比為2:2:2:2:1:1的結構簡式_____________
有多種同分異構體,其中符合下列要求的共有_____________種(不考慮立體異構),寫出其中核磁共振氫譜為6組峰,且峰面積比為2:2:2:2:1:1的結構簡式_____________
①能與 NaHCO3反應放出CO2
②能與FeCl3溶液發生顯色反應
③苯環上的一取代物有兩種
(6)請用合成反應流程圖表示出由A和其他無機物合成 最合理的方案。_______________
最合理的方案。_______________
例:  。
。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某同學通過如下流程制備氧化亞銅:
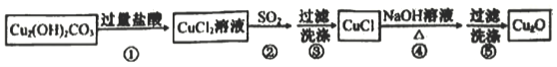
已知CuCl難溶于水和稀硫酸:Cu2O+2H+==Cu2++Cu+H2O
下列說法不正確的是
A. 步驟②SO2可用Na2SO3替換
B. 步驟③中為防止CuCl被氧化,可用SO2水溶液洗滌
C. 步驟④發生反應的離子方程式為2CuCl+2OH-=Cu2O+2Cl-+H2O
D. 如果Cu2O試樣中混有CuCl和CuO雜質,用足量稀硫酸與Cu2O試樣充分反應,根據反應前、后固體質量可計算試樣純度
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】硫酸亞鐵銨品體[(NH4)2Fe(SO4)2·6H2O]又稱摩爾鹽,是一種重要的化工原料,用途十分廣泛。
(1)基態Fe2+的核外電子排布式為_____________________。
(2)氨是合成摩爾鹽的重要原料,工業合成氨中,原料氣在進入合成塔前常用醋酸二氨合銅(I)溶液來吸收其中的雜質CO氣體,其反應方程式為:[Cu(NH3)2]Ac+CO+NH3![]() [Cu(NH3)3]Ac·CO[醋酸羰基三氨合銅(I)](Ac-=CH3COO-)
[Cu(NH3)3]Ac·CO[醋酸羰基三氨合銅(I)](Ac-=CH3COO-)
①醋酸中碳原子的雜化方式是_________,1mol乙酸分子中含有σ鍵的數目為_________________。
②C、N、O三種元素的第一電離能由小到大的順序為___________________________。
③與CO互為等電子體的分子為___________(填化學式),NH3的空間構型為__________________。
(3)N和P都是第VA族元素,其最簡單氫化物熔點的大小關系為_________,主要原因是__________________________________。
(4)鐵在不同溫度范圍有不同的晶體結構。室溫下鐵是簡單立方,稱為α鐵(α-Fe)。當溫度升高到912℃,α鐵轉變為面心立方,稱為γ鐵(γ-Fe)。當溫度繼續升高到1394 ℃,γ鐵轉變為體心立方。稱為δ鐵(δ-Fe)。

①γ鐵晶體中鐵原子配位數是____________________。
②δ鐵晶體密度為dg·cm-3,則其晶胞參數(邊長)為__________cm(阿伏加德羅常數用NA表示)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列實驗方案不能達到實驗目的的是

A. 圖A裝置Cu和濃硝酸制取NO B. 圖B裝置實驗室制備Cl2
C. 圖C裝置實驗室制取乙酸乙酯 D. 圖D裝置實驗室分離CO和CO2
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】錳的用途非常廣泛,以碳酸錳礦(主要成分為MnCO3,還含有鐵、鎳、鈷的碳酸鹽及SiO2雜質)為原料生產金屬錳的工藝流程如下:

已知25℃,部分物質的溶度積常數如下:
物質 | Mn(OH)2 | Co(OH)2 | Ni(OH)2 | Fe(OH)3 | MnS | CoS | NiS |
Ksp | 2.1×10-13 | 3.0×10-16 | 5.0×10-16 | 1.1×10-36 | 1.0×10-11 | 5.0×10-22 | 1.0×10-22 |
(1)步驟Ⅰ中,為加快溶浸速率,可采取的措施是____________________(至少答兩條)
(2)步驟Ⅱ中,加氨水調節溶液的pH為5.0~6.0,則濾渣1的成分主要為______(填化學式);已知MnO2的作用為氧化劑,“除雜1”中涉及的離子方程式為:NH3﹒H2O+H+==NH4+ +H2O、__________________、___________________。
(3)步驟Ⅲ中,所加(NH4)2S的濃度不宜過大的原因是_______________________。
(4)濾液2中,c(Co2+) :c(Ni2+)=_______________。
(5)將質量為a㎏的碳酸錳礦經上述流程處理后得到單質Mn b kg。若每一步都進行完全,假設濾渣1為含鐵元素的純凈物,質量為c kg,則原碳酸錳礦中MnCO3的質量分數為_________(用含a、b、c的式子表達,無需化簡)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】現有以下物質①NaCl晶體②CO2③液態的純醋酸④銅⑤BaSO4固體⑥蔗糖⑦酒精⑧氨水,請回答下列問題(填序號)
(1)能導電的是
(2)屬于電解質的是
(3)屬于非電解質的是 .
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列科研成果不是由我國發明或創造的是( )
A.世界上第一個由人工合成的、具有生理活性的蛋白質﹣﹣結晶牛胰島素
B.黑火藥和造紙
C.發現元素周期律
D.青蒿素的合成
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com