
【題目】主族元素W、X、Y、Z的原子序數依次增加,且均小于20。W、X、Y、Z的族序數之和為12;X與Y的電子層數相同;向過量的ZWY溶液中滴入少量膽礬溶液,觀察到既有黑色沉淀生成又有臭雞蛋氣味的氣體放出。下列說法正確的是( )
A. ZWY是離子化合物,既可以與酸反應又可以與堿反應
B. 晶體X熔點高、硬度大,可用于制造光導纖維
C. 原子半徑由小到大的順序為:![]()
D. 熱穩定性:![]()
【答案】A
【解析】
主族元素W、X、Y、Z的原子序數依次增加,且均不大于20。向過量的ZWY溶液中滴入少量硫酸銅溶液,觀察到既有黑色沉淀生成又有臭雞蛋氣味的氣體放出,臭雞蛋氣體的氣體為H2S,黑色沉淀為CuS,ZWY為NaHS或KHS;由于W、X、Y、Z的族序數之和為12,X的族序數=12-1-1-6=4,X與Y的電子層數相同,二者同周期,且原子序數不大于20,則X只能為Si,Y為S元素;Z的原子序數大于S,則Z為K元素。
W為H,X為Si元素,Y為S,Z為K元素
A、KHS屬于離子化合物,屬于弱酸鹽,可以和強酸反應,屬于酸式鹽,可以和堿反應,故A正確;
B、晶體Si熔點高、硬度大,是信息技術的關鍵材料,故B錯誤;
C、同一周期從左向右原子半徑逐漸減小,同一主族從上到下原子半徑逐漸增大,則原子半徑r(W)<r(Y)<r(X)<r(Z),故C錯誤;
D、X為Si元素,Y為S,非金屬性Si<S,熱穩定性:SiH4< H2S,故D錯誤;
故選A。


 應用題點撥系列答案
應用題點撥系列答案 狀元及第系列答案
狀元及第系列答案 同步奧數系列答案
同步奧數系列答案科目:高中化學 來源: 題型:
【題目】某小組利用如下裝置制備Cu(NH3)xSO4·H2O(溶于水呈深藍色).并測量x值。

(Cu(NH3)xSO4·H2O制備)見圖1
(1)A中發生的化學反應方程式為_____________________________ 。
(2)B中觀察到的現象是_______________________;C中CCl4的作用是 ______________。
(3)欲從Cu(NH3)xSO4溶液中析出Cu(NH3)xSO4·H2O晶體,可加入試劑 _______________ 。
(x值的測量)見圖2
步驟一:檢查裝置氣密性,稱取0.4690g晶體[M = (178+17x)g/mol]于錐形瓶a中;
步驟二:通過分液漏斗向錐形瓶a中滴加l0%NaOH溶液;
步驟三:用0. 5000 mol/L的NaOH標液滴定b中剩余HCI,消耗標液16. 00 mL。
(4)步驟二的反應可理解為Cu(NH3)xSO4與NaOH在溶液中反應,其離子方程式為 ______。
(x值的計算與論證)
(5)計算:x = __________ ,
該學習小組針對上述實驗步驟,提出測量值(x)比理論值偏小的原因如下:
假設1:步驟一中用于稱量的天平砝碼腐蝕缺損;
假設2:步驟二中 _______________________________________________(任寫兩點);
假設3 :步驟三中測定結束讀數時,體積讀數偏小。該假設_____(填“成立”或“不成立”)。
(6)針對假設l,你對實驗的處理意見是________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】利用所學化學知識,分析并回答下列各小題。

(1)下列物質屬于圖1所示化學概念交叉部分的有______(填標號)。
a.氨氣 b.硝酸 c.乙醇 d.醋酸鈉
(2)下列各反應屬于圖2中陰影部分所示關系的有_______(填標號)。
a.氨氣與濃硝酸
b.氫氣與氧氣
c.氯氣與氯化亞鐵溶液
d.銅與氯化鐵溶液
(3)下列有關說法正確的是_____(填標號)。
a.核電站把核能轉化為電能
b.常溫下銅與濃硫酸發生鈍化。反應很快停止
c.海水中提取化學物質均涉及到氧化還原反應
d.電解法得到某元素單質,則該元素可能被還原,也可能被氧化
(4)下列各實驗過程中,需要檢查所用某些儀器是否漏水的有_______(填標號)。
a.氫氣還原氧化銅
b.水與煤油混合物分離
c.氯化鈉溶液與泥沙分離
d.配制100mL 10mol·L-1碳酸鈉溶液
(5)下列關于試劑保存的敘述正確的是_________(填標號)。
a.氫氟酸保存在玻璃瓶中
b.KOH溶液保存在帶玻璃塞的細口瓶中
c.溴水保存在帶橡膠塞的棕色瓶中
d.KMnO4與乙醇不能放在同一藥品廚中
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】一定溫度下,在一固定體積的密閉容器中,能說明可逆反應A (g)+3B (g)![]() 2C (g)達到平衡的說法中,正確的組合是
2C (g)達到平衡的說法中,正確的組合是
①C 的生成速率和 C 的分解速率相等
②單位時間內生成 a mol A,同時生成 3a mol B
③氣體密度不再變化
④ 混合氣體的平均相對分子質量不變
⑤A、B、C 的物質的量之比為 1∶3∶2
A.①④B.②③⑤C.①④⑤D.④⑤
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】從牛至精油中提取的三種活性成分的結構簡式如下圖所示,下列說法正確的是
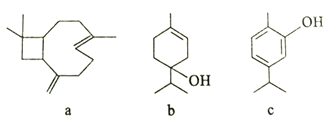
A. a中含有2個手性碳原子(手性碳原子指連有四個不同基團的碳原子)
B. b分子存在屬于芳香族化合物的同分異構體
C. c分子中所有碳原子可能處于同一平面
D. a、b、c均能發生加成反應、取代反應、加聚反應
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】氫氧燃料電池構造如圖所示。其電池反應方程式為:2H2+O2=2H2O
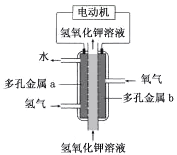
下列說法不正確的是
A. 多孔金屬a作負極
B. 多孔金屬b上,O2發生還原反應
C. 電池工作時,電解質溶液中OH- 移向a極
D. 正極的電極反應為:O2 +4e- +4H+ =2H2O
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】(1)3.01×1024個OH的物質的量為________mol,含有電子的數目為________,這些OH和________gNa+含有的電子數相同。
(2)標準狀況下,1.92g某氣體的體積為672mL,則該氣體的摩爾質量為______;
(3)實驗室為確定一瓶稀鹽酸的濃度,用0.1000mol/LNaOH溶液中和25.00mL該鹽酸,當酸與堿恰好完全反應時,消耗NaOH溶液24.50mL。該鹽酸的物質的量濃度為______;
(4)實驗室可以用高錳酸鉀和濃鹽酸反應制備氯氣:2KMnO4+16HCl(濃)=2KCl+2MnCl2+5Cl2↑+8H2O,用雙線橋標出電子轉移的方向和數目___________,該反應中被氧化的元素是________,參加反應的氧化劑與還原劑的物質的量之比為________,如果該反應過程中轉移了5mol電子,生成的氯氣在標準狀況下體積為__________L(假設氣體全部逸出)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】實驗室常用![]() 與濃鹽酸反應制備
與濃鹽酸反應制備![]() 。
。
(1)制備反應會因鹽酸濃度下降面停止。為測定反應殘余液中鹽酸的濃度,探究小組同學提出下列實驗方案:
甲方案:與足量![]() 溶液反應,稱量生成的
溶液反應,稱量生成的![]() 質量。
質量。
乙方案:采用酸堿中和滴定法測定。
丙方案:與己知量![]() (過量)反應,稱量剩余的
(過量)反應,稱量剩余的![]() 質量。
質量。
丁方案:與足量![]() 反應,測量生成的
反應,測量生成的![]() 體積。
體積。
繼而進行下列判斷和實驗:
①判定甲方案不可行。現由是_________。
②進行乙方案實驗;準確量取殘余清液稀釋一定倍數后作為試樣。
a.量取試樣![]() ,用
,用![]() 標準溶液滴定,選擇的指示劑是____,消耗
標準溶液滴定,選擇的指示劑是____,消耗![]() ,該次滴定測得試樣中鹽酸濃度為_______
,該次滴定測得試樣中鹽酸濃度為_______![]()
b._________,獲得實驗結果。
③判斷兩方案的實驗結果________(填“偏大”、“偏小”或“準確”).
[已知:![]() 、
、![]() ]
]
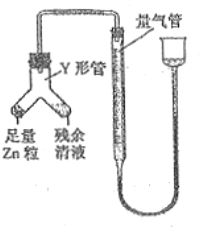
④進行丁方案實驗:裝置如圖所示(夾持器具已略去)。
a.使Y形管中的殘余清液與鋅粒反應的正確操作是將_______轉移到____中。
b.反應完畢,每間隔1分鐘讀取氣體體積,氣體體積逐次減小,直至不變。氣體體積逐次減小的原因是__________(排除儀器和實驗操作的影響因素),至體積不變時,量氣管的左側液面高于右側液面,此時讀數測得的體積__________(填“偏大”、“偏小”或“準確”)
(2)若沒有酒精燈,也可以采用![]() 與濃鹽酸反應制取適量氯氣的如下簡易裝置。
與濃鹽酸反應制取適量氯氣的如下簡易裝置。
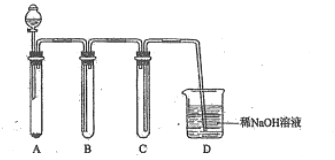
裝置B、C、D的作用分別是:
B___________C______________D______________
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】向200 mL FeBr2溶液中逐漸通入Cl2,其中n(Fe 3+)、n(Br2) 隨通入n(Cl2)的變化如圖所示,下列說法不正確的是( )

A.氧化性強弱:Br2 > Fe3+
B.由圖可知,該FeBr2溶液的濃度為1 mol·L-l
C.n(Cl2)=0. 12 mol時,溶液中的離子濃度有c (Fe 3+)∶c( Br-)=1∶8
D.n(FeBr2)∶n(Cl2)=1∶1時,反應的離子方程式為:2Fe2++2Br- + 2Cl2=2Fe3++Br2 + 4Cl-
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com