
【題目】GaAs晶體的熔點很高, 硬度很大, 密度為ρ g·cm-3,Ga 和As 的摩爾質量分別為MGag·mol-1和MAs g·mol-1, 原子半徑分別為rGa pm 和rAs pm, 阿伏加德羅常數值為NA, 其晶胞結構如下圖所示, 下列說法錯誤的是
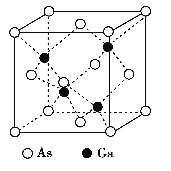
A. 該晶體為原子晶體
B. 在該晶體中,Ga和As均無孤對電子,Ga和As的配位數均為4
C. 原子的體積占晶胞體積的百分率為![]()
D. 所有原子均滿足8電子穩定結構
【答案】C
【解析】
A.GaAs 晶體的熔點很高,硬度很大,符合原子晶體的特點;
B.由晶胞結構可知,晶胞中As、Ga原子數目之比為1:1,As、Ga配位數相同,Ga與周圍4個As原子形成正四面體結構,As與周圍4個Ga原子也形成正四面體結構,原子均形成4個鍵,Ga原子價電子為3,與As形成4個共價鍵,說明As原子提供1對孤電子對給Ga形成配位鍵;
C.均攤法計算晶胞中各原子數目,再計算原子總體積,結合密度計算晶胞體積,空間利用率=晶胞最近原子總體積/晶胞體積×100%;
D.每個As、Ga原子都形成4個共價鍵,均沒有孤電子對。
A.GaAs 晶體的熔點很高,硬度很大,為空間立體網站結構,屬于原子晶體,故A正確;
B.由晶胞結構可知,Ga的配位數為4,晶胞中Ga原子數目=4,As原子數目=8×1/8+6×1/2=4,晶胞中As、Ga原子數目之比為1:1,故As配位數也是4,Ga與周圍4個As原子形成正四面體結構,As與周圍4個Ga原子也形成正四面體結構,原子均形成4個鍵,Ga原子價電子為3,與As形成4個共價鍵,說明As原子提供1對孤電子對給Ga形成配位鍵,As原子最外層5個電子全部成鍵,均沒有孤電子對,故B正確;
C.晶胞中原子總體積=4×4/3π(rGa3+rAs3 )×10-30 cm3,晶胞質量=4×(MGa+MAs)/NA g,晶胞體積=(4×(MGa+MAs)/NA g)÷ρ g·cm-3,原子的體積占晶胞體積的百分率=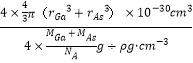 ×100%=4πρNA(r3Ga+r3As)/3(MGa+MAs)×10-30×100%,故C錯誤;
×100%=4πρNA(r3Ga+r3As)/3(MGa+MAs)×10-30×100%,故C錯誤;
D.每個As、Ga原子都形成4個共價鍵,均沒有孤電子對,所有原子均滿足 8 電子穩定結構,故D正確,
故選:C。


 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源: 題型:
【題目】下列一句話中敘述了兩個值,前者記為![]() ,后者記為
,后者記為![]() ,
,![]() 和
和![]() 的關系從A、B、C、D中選擇,并填空。
的關系從A、B、C、D中選擇,并填空。
A.![]() B.
B.![]() C.
C.![]() D.無法比較
D.無法比較
(1)常溫下![]() 的
的![]() 與
與![]()
![]() 等體積混合后溶液中
等體積混合后溶液中![]() 和
和![]() :______;
:______;
(2)同溫度下,![]()
![]() 溶液中
溶液中![]() 水解百分率與
水解百分率與![]() 溶液中
溶液中![]() 的水解百分率:______;
的水解百分率:______;
(3)pH值相同的醋酸和鹽酸,分別用蒸餾水稀釋至原來的![]() 倍和
倍和![]() 倍,稀釋后兩溶液的
倍,稀釋后兩溶液的![]() 值仍然相同,則
值仍然相同,則![]() 和
和![]() 的關系是:______;
的關系是:______;
(4)常溫下兩份等濃度的純堿溶液,將第二份升高溫度,兩溶液中![]() :______;
:______;
(5)相同溫度下,![]() 值為12的燒堿溶液中水的電離度和
值為12的燒堿溶液中水的電離度和![]() 值為12的
值為12的![]() 溶液中水的電離度:______;
溶液中水的電離度:______;
(6)將![]() 值為2的鹽酸和醋酸都稀釋相同倍數所得稀溶液的
值為2的鹽酸和醋酸都稀釋相同倍數所得稀溶液的![]() 值:______;
值:______;
(7)室溫下某強酸和某強堿溶液等體積混合后,溶液的![]() 值為7,原酸溶液和原堿溶液的物質的量濃度:______;
值為7,原酸溶液和原堿溶液的物質的量濃度:______;
(8)相同溫度下,![]() 的
的![]() 溶液中的
溶液中的![]() 個數和
個數和![]()
![]() 溶液中
溶液中![]() 的個數:______。
的個數:______。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】向FeI2、FeBr2的混合溶液中通入適量氯氣,溶液中某些離子的物質的量變化情況如圖所示.則下列說法中不正確的是

A.還原性:I->Fe2+>Br-
B.原混合溶液中FeBr2的物質的量為3mol
C.線段AB表示Fe2+被氯氣氧化
D.原溶液中:n(Fe2+):n(I-):n(Br-)═2:1:3
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】現有如下各種說法:
①金屬和非金屬化合時一定形成離子鍵;
②離子鍵是陽離子、陰離子的相互吸引力;
③根據電離方程式HCl![]() H++Cl-,判斷氯化氫分子里存在離子鍵;
H++Cl-,判斷氯化氫分子里存在離子鍵;
④氫氣和氯氣的反應過程:H2、Cl2分子里共價鍵發生斷裂生成H原子、Cl原子,而后H原子、Cl原子形成離子鍵的過程
上述各種說法正確的是
A. ①② B. 都不正確 C. ①②④ D. ①
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在20世紀90年代末期,科學家發現并證明碳有新的單質形態![]() 存在。后來人們又相繼得到了
存在。后來人們又相繼得到了![]() 、
、![]() 、
、![]() 、
、![]() 等另外一些球碳分子。21世紀初,科學家又發現了管狀碳分子和洋蔥狀碳分子,大大豐富了碳元素單質的家族。下列有關說法錯誤的是
等另外一些球碳分子。21世紀初,科學家又發現了管狀碳分子和洋蔥狀碳分子,大大豐富了碳元素單質的家族。下列有關說法錯誤的是

A. 熔點比較: ![]()
B. ![]() 、
、![]() 、管狀碳和洋蔥狀碳之間的轉化屬于化學變化
、管狀碳和洋蔥狀碳之間的轉化屬于化學變化
C. ![]() 晶體結構如上圖所示,每個
晶體結構如上圖所示,每個![]() 分子周圍與它最近且等距離的
分子周圍與它最近且等距離的![]() 分子有12個
分子有12個
D. ![]() 、
、![]() 、管狀碳和洋蔥狀碳都不能與
、管狀碳和洋蔥狀碳都不能與![]() 發生反應
發生反應
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某元素的一種同位素X的原子質量數為A,含N個中子,它與![]() 原子組成HmX分子.在a克HmX中所含質子的物質的量是( )
原子組成HmX分子.在a克HmX中所含質子的物質的量是( )
A. ![]() (A-N+m)molB.
(A-N+m)molB. ![]() (A-N)molC.
(A-N)molC. ![]() (A-N)molD.
(A-N)molD. ![]() (A-N+m)mol
(A-N+m)mol
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】鋅錳干電池是最早的實用電池。現用下列工藝回收正極材料中的金屬(部分條件未給出)。

(1)堿性鋅錳電池反應為:Zn+2MnO2+2H2O=Zn(OH)2+2MnO(OH),電解質是KOH, MnO(OH)中Mn的化合價為:_____,正極反應式為:__________。
(2)黑粉的主要成份為 MnO2和石墨,寫出反應①的化學方程式:________
(3)MnO2的轉化率與溫度的關系如下表:
溫度/℃ | 20 | 40 | 60 | 80 | 100 |
轉化率/℃ | 86.0 | 90.0 | 91.3 | 92.0 | 92.1 |
生產中常選反應溫度為80℃,其理由是:___________。
(4)“沉錳”過程中生成堿式碳酸錳[MnCO36Mn(OH)25H2O],寫出其離子反應方程式:_______。濾液③中可回收的物質為:________(填化學式)。
(5)用硫酸酸化的![]() 漿液可吸收工業廢氣中的
漿液可吸收工業廢氣中的![]() 生成
生成![]() ,已知漿液中
,已知漿液中![]() 含量為
含量為![]() ,工業廢氣中
,工業廢氣中![]() 含量為
含量為![]() ,
, ![]() 的吸收率可達90%,則處理1000
的吸收率可達90%,則處理1000![]() 工業尾氣,可得到
工業尾氣,可得到![]() 的質量為____kg(用含字母的代數式表示)。
的質量為____kg(用含字母的代數式表示)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列離子方程式書寫正確的是
A.銅粉加入氯化鐵溶液中:Cu + Fe3+ = Fe2++Cu2+
B.將稀硫酸滴在銅片上:Cu + 2H+ =Cu2++ H2↑
C.氯氣與燒堿溶液反應:Cl2+2OH-=ClO-+Cl-+H2O
D.將少量銅屑放入稀硝酸中:Cu+4H++2NO![]() = Cu2++2NO2↑+2H2O
= Cu2++2NO2↑+2H2O
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】如圖是實驗室制備SO2并驗證SO2某些性質的裝置圖。試回答:

(1)寫出儀器A的名稱___,寫出此實驗中制備SO2化學方程式___。
(2)C中的現象是___,此實驗證明SO2是___氣體。
(3)D中的反應現象證明SO2有___性;F中的現象是___,G中SO2與碘水反應的方程式:___。
(4)H中的試劑是氫氧化鈉溶液,用于吸收多余的二氧化硫氣體,防止污染空氣;反應的離子方程式為___。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com