
【題目】2Zn(OH)2·ZnCO3是制備活性ZnO的中間體,以鋅焙砂(主要成分為ZnO,含少量Cu2+、Mn2+等離子)為原料制備2Zn(OH)2·ZnCO3的工藝流程如下:

(1)用(NH4)2SO4與NH3·H2O的混合溶液浸取鋅焙砂生成[Zn(NH3)4]2+的過程中加入H2O2的目的是________。
(2)加入(NH4)2S除雜過程中的主要離子方程式為________。
(3)過濾3所得濾液可循環使用,其主要成分的化學式是_______。
(4)檢驗2Zn(OH)2·ZnCO3沉淀是否洗滌干凈的方法是________。
(5)寫出沉鋅步驟中發生反應的化學方程式________。
【答案】將Mn2+氧化為MnO2除去Cu2++S2-=CuS↓(NH4)2SO4取最后一次洗滌液少許于試管中,滴加稀鹽酸和BaCl2溶液,若無明顯現象,則沉淀已洗滌干凈3ZnSO4+6NH4HCO3=2Zn(OH)2·ZnCO3↓+5CO2↑+3(NH4)2SO4+H2O
【解析】
制備2Zn(OH)2·ZnCO3流程為:鋅焙砂(主要成分為ZnO,含少量Cu2+、Mn2+等離子)中加入硫酸銨、氨水、雙氧水,雙氧水將錳離子氧化成二氧化錳,過濾后在濾液中加硫化銨,再過濾,除去銅離子,蒸氨除去多余的氨氣,加入碳酸氫銨得到2Zn(OH)2·ZnCO3和二氧化碳氣體,過濾得2Zn(OH)2·ZnCO3,濾液為硫酸銨溶液,據此解答。
(1)雙氧水具有強氧化性,還原產物是水,不會引入新雜質,因此加入H2O2的目的是將錳離子氧化成二氧化錳而除去錳;
(2)根據以上分析可知加入(NH4)2S的目的是除去銅離子,則除雜過程中的主要離子方程式為Cu2++S2-=CuS↓;
(3)根據上面的分析可知,過濾3所得濾液為硫酸銨溶液,(NH4)2SO4可以循環使用;
(4)根據上面的分析可知,過濾3所得濾液為硫酸銨溶液,因此證明2Zn(OH)2·ZnCO3沉淀洗滌完全即證明沉淀洗滌濾液中有沒有硫酸根離子,所以操作為取最后一次洗滌液少許于試管中,滴加稀鹽酸和BaCl2溶液,若無明顯現象,則沉淀已洗滌干凈;
(5)加入碳酸氫銨得到2Zn(OH)2·ZnCO3和二氧化碳氣體,根據原子守恒可知還有硫酸銨和水生成,則沉鋅步驟中發生反應的化學方程式為3ZnSO4+6NH4HCO3=2Zn(OH)2·ZnCO3↓+5CO2↑+3(NH4)2SO4+H2O。


 心算口算巧算一課一練系列答案
心算口算巧算一課一練系列答案科目:高中化學 來源: 題型:
【題目】有機物F(Bisphenol A dimethacrylate)是一種交聯單體。合成F的一種路線如下:
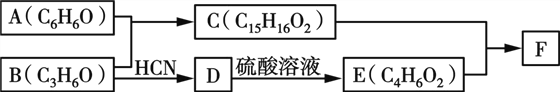
已知:
①![]() +HCN
+HCN![]()
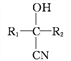
②B不能發生銀鏡反應。
③C能與FeCl3發生顯色反應,核磁共振氫譜顯示有4種不同化學環境的氫。
④E既能使溴水褪色又能使石蕊試液顯紅色。
⑤1 mol F最多可與4 mol NaOH反應。
回答下列問題:
(1)A與B反應的化學方程式為________________。
(2)B→D的反應類型為____,E的結構簡式為________。
(3)F的結構簡式為____________。
(4)C的同分異構體中含有萘環(![]() )結構,萘環上只有1個取代基且水解產物之一能與FeCl3溶液發生顯色反應的同分異構體共有____種(不考慮立體異構),其中核磁共振氫譜有8組峰的是____________(寫出其中一種的結構簡式)。
)結構,萘環上只有1個取代基且水解產物之一能與FeCl3溶液發生顯色反應的同分異構體共有____種(不考慮立體異構),其中核磁共振氫譜有8組峰的是____________(寫出其中一種的結構簡式)。
(5)A經如下步驟可合成環己烯甲酸:
A![]() G
G![]() H
H![]() I
I![]()
![]()
反應條件1為________;反應條件2為______;反應條件3所選擇的試劑為____;I的結構簡式為____。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】將一定質量的鎂鋁合金投入100mL一定物質的量濃度的鹽酸中,若合金全部溶解,向所得溶液中滴加10.0 mol/L NaOH溶液至過量,生成沉淀的質量與加入氫氧化鈉溶液體積的關系如下圖所示。

(1)當加入NaOH溶液80mL到90mL時,發生反應的離子方程式為:_______________________________。
(2)當沉淀達到最大值時,其中Al(OH)3的質量為______________g;
(3)原鹽酸的物質的量濃度為_______________mol/L;
(4)若所取鹽酸的體積和濃度均保持不變,為保證加入100mL 10.0 mol/L NaOH溶液時最終無 Al(OH)3生成,則此時所取合金中含Al的物質的量即n(Al)的取值范圍為_________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】
實驗目的:探究過氧化鈉與水反應后的溶液滴加酚酞試液先變紅后褪色的原因。
(分析與猜想)根據過氧化鈉與水反應的原理:![]() ,往過氧化鈉固體完全溶解反應后的溶液中滴加酚酞本應只會變紅而不會褪色,而實驗中發現酚酞變紅后又褪色。
,往過氧化鈉固體完全溶解反應后的溶液中滴加酚酞本應只會變紅而不會褪色,而實驗中發現酚酞變紅后又褪色。
(1)由此提出如下的猜想:
A.氧氣有漂白性B B.氫氧化鈉有漂白性 C.______
(2)根據以上實驗分析發現:過氧化鈉與水反應過程中,鈉元素形成了穩定的化合物,溶液中還生成了一種不很穩定、具有漂白性的物質![]() ,
,![]() 的化學式是______。
的化學式是______。
(3)可用右圖裝置對溶液中不很穩定的物質進行探究,在①處裝入的物質是______(填選項,下同),②處裝入的物質是______。
A.酚酞試劑 B.過氧化鈉與水反應后的溶液
C.二氧化錳 D.氫氧化鈉固體配制的溶液
(4)氣體③是______,過氧化鈉與水反應的化學方程式沒有寫出![]() 來,原因是______。
來,原因是______。

查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】(1)相同溫度下,將足量氯化銀固體分別放入相同體積的①蒸餾水、
②0.1 mol·L-1鹽酸、③0.1 mol·L-1氯化鎂溶液、④0.1 mol·L-1 硝酸銀溶液中,
其中Ag+濃度最小的是____________。(填序號)
(2)電解氯化鈉可以得到多種化工原料。用于電解的食鹽水需先除去其中的Ca2+、Mg2+、SO![]() 等雜質。某次除雜操作時,往粗鹽水中先加入過量的BaCl2溶液,至沉淀不再產生后,再加入過量的Na2CO3和NaOH,充分反應后將沉淀一并濾去。經檢測發現濾液中仍含有一定量的SO
等雜質。某次除雜操作時,往粗鹽水中先加入過量的BaCl2溶液,至沉淀不再產生后,再加入過量的Na2CO3和NaOH,充分反應后將沉淀一并濾去。經檢測發現濾液中仍含有一定量的SO![]() ,其原因是______________________________[已知:Ksp(BaSO4)=1.1×10-10、Ksp(BaCO3)=2.6×10-9]。
,其原因是______________________________[已知:Ksp(BaSO4)=1.1×10-10、Ksp(BaCO3)=2.6×10-9]。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某同學為了探究鈉與CO2的反應,利用如圖裝置進行實驗。(已知PdCl2能被CO還原為黑色的Pd)

(1)裝置②中用稀鹽酸與CaCO3反應制備CO2,在加稀鹽酸時,發現CaCO3與稀鹽酸不能接觸,而稀鹽酸又不夠了,為使反應能順利進行,可向長頸漏斗中加入的試劑是_______。
A. H2SO4溶液 B. CCl4 C. 苯 D. 稀硝酸
(2)請將圖中各裝置按順序連接(填裝置接口字母):c接______,______接____,____接______,____接____。
(3)裝置④的作用是__________。
(4)檢查完裝置氣密性并裝好藥品后,點燃酒精燈之前應進行的操作是打開彈簧夾,讓CO2充滿整個裝置,當觀察到_________時再點燃酒精燈。
(5)若反應過程中CO2足量,鈉與CO2充分反應后,生成的固體物質可能有多種情況,該同學提出以下猜想:
①生成的固體物質為Na2CO3
②生成的固體物質為Ns2CO3和C的混合物
③生成的固體物質為Ns2CO3和Na2O的混合物
④生成的固體物質為Ns2O和C的混合物
假如反應過程中有下列兩種情況:
I. 觀察到裝置⑤PdCl2溶液中有黑色沉淀,若裝置①中固體成分只有一種,且向固體中加入稀鹽酸可產生能使澄清石灰水變渾濁的氣體,寫出該情況下鈉與CO2反應的化學方程式____。
II. 裝置①中鈉的質量為0.46g,充分反應后,將裝置①中的固體加入足量的稀鹽酸中產生224ml(標準狀況)CO2氣體,溶液中殘留固體的質量為___________。
(6)設計實驗方案證明裝置①中加入的金屬鈉部分被氧化____________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】25℃時,0.1mol·L-1的某一元酸HA在水中有0.1%發生電離,下列說法不正確的是
A.該溶液pH=4
B.由HA電離出的c(H+)約為水電離的c(H+)的106倍
C.此酸的電離平衡常數約為1×10-7
D.升高溫度,溶液的pH增大
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列實驗設計及其對應的離子方程式均正確的是( )
A. 醋酸溶液除去水垢中的CaCO3:CaCO3+2H+![]() Ca2++H2O+CO2↑
Ca2++H2O+CO2↑
B. 向稀鹽酸溶液中加入鐵粉:2Fe+6 H+![]() 2Fe3+ + 3H2↑
2Fe3+ + 3H2↑
C. 用FeCl3溶液腐蝕銅線路板:Cu + 2Fe3+ ![]() Cu2+ + 2 Fe2+
Cu2+ + 2 Fe2+
D. 向氯化亞鐵溶液中通入氯氣:Fe2+ +Cl2=Fe3+ +2Cl-
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列有關金屬的工業制法中,正確的是
A. 以海水為原料制得精鹽,再電解精鹽的水溶液制取鈉
B. 用海水、石灰乳等為原料,經一系列過程制得氧化鎂,用H2還原氧化鎂制得鎂
C. 以鐵礦石、焦炭、空氣、石灰石等為原料,通過反應產生的CO在高溫下還原鐵礦石制得鐵
D. 從鋁土礦中獲得氧化鋁再制得氯化鋁固體,電解熔融的氯化鋁得到鋁
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com