
【題目】25℃時將10mL pH=11的氨水加水稀釋至100mL,下列判斷正確的是( )
A.稀釋后溶液的pH=10
B.氨水的電離度增大,溶液中所有離子的濃度均減小
C.稀釋過程中![]() 增大
增大
D.pH=11氨水的濃度為0.001mol·L-1
【答案】C
【解析】
A.一水合氨是弱電解質,在水溶液里部分電離,加水促進電離,將10mLpH=11的氨水加水稀釋至100mL,體積增大10倍,pH變化小于1個單位,即稀釋后10<pH<11,故A錯誤;
B.加水稀釋促進一水合氨電離,溶液中c(OH﹣)減小,溫度不變,則水的離子積常數不變,則溶液中c(H+)增大,故B錯誤;
C.加水稀釋氨水,促進一水合氨電離,導致溶液中n(NH4+)增大、n(NH3.H2O)減小,在同一溶液中,V相同,則溶液中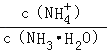 增大,故C正確;
增大,故C正確;
D.一水合氨是弱電解質,在水溶液里部分電離,則溶液中氨水濃度大于氫氧根離子的濃度,則pH=11氨水中的c(OH-)=10-3mol/L,所以氨水的濃度大于0.001mol/L,故D錯誤;
故答案選C。


科目:高中化學 來源: 題型:
【題目】1,2-二溴乙烷的制備原理是:CH3CH2OH![]() CH2=CH2↑+H2O CH2=CH2+Br2→BrCH2—CH2Br;某課題小組用下圖所示的裝置制備1,2-二溴乙烷。
CH2=CH2↑+H2O CH2=CH2+Br2→BrCH2—CH2Br;某課題小組用下圖所示的裝置制備1,2-二溴乙烷。

回答下列問題:
(1)裝置B的作用是_______。
(2)三頸燒瓶內加入一定量的乙醇-濃硫酸混合液和少量粗砂,其加入粗砂目的是_______,儀器E的名稱是_______。
(3)裝置C內發生的主要反應的離子方程式為_______。
(4)加熱三頸燒瓶前,先將C與D連接處斷開,再將三頸燒瓶在石棉網上加熱,待溫度升到約120℃時,連接C與D,并迅速將A內反應溫度升溫至160~180℃,從滴液漏斗中慢慢滴加乙醇-濃硫酸混合液,保持乙烯氣體均勻地通入裝有3.20mL液溴(ρ液溴=3g/cm3)和3mL水的D中試管,直至反應結束。
①將C與D連接處斷開的原因是_______
②判斷反應結束的現象是_______
(5)將粗品移入分液漏斗,分別用水、氫氧化鈉溶液、水洗滌,產品用無水氯化鈣干燥,過濾后蒸餾收集129~133℃餾分,得到7.896g1,2-二溴乙烷。1,2-二溴乙烷的產率為_______。
(6)下列操作中,不會導致產物產率降低的是(填正確答案的標號)_______.
a.乙烯通入溴水時速率太快 b.裝置E中的NaOH溶液用水代替.
c.去掉裝置D燒杯中的水 d.實驗時沒有C裝置
e.D中的試管里不加水
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】Ⅰ.有一應用前景廣闊的納米材料甲,其由A、B兩種短周期非金屬元素組成,難溶于水,且硬度大,熔點高。取材料甲與熔融的燒堿反應,生成一種含A元素的含氧酸鹽乙和一種含B元素的氣體丙,丙能使濕潤的紅色石蕊試紙變藍;乙能溶于水,加鹽酸產生白色沉淀,鹽酸過量沉淀不溶解。
(1)甲的化學式為_________,其晶體屬于________晶體
(2)乙的水溶液可以用來做__________________(寫出一種用途)
(3)B元素的一種氫化物丁,相對分子質量為32,常溫下為液體,其燃燒放熱多且燃燒產物對環境無污染,因此可用作火箭燃料、燃料電池燃料等。則丁的電子式為_____________。
Ⅱ.某銅制品在潮濕環境中發生的電化學腐蝕過程可表示為如圖,腐蝕后有A物質生成,某小組為分析A物質的組成,進行了如下實驗:
實驗①:取A樣品,加過量稀硝酸完全溶解后,再加入AgNO3溶液,有白色沉淀生成。
實驗②:另取A樣品4.29g,加入含![]() 的稀硫酸溶液,恰好中和,生成兩種鹽的混合溶液。向所得混合溶液中加入適量的NaOH溶液,產生藍色沉淀,經過濾、洗滌、灼燒得3.20g黑色固體。
的稀硫酸溶液,恰好中和,生成兩種鹽的混合溶液。向所得混合溶液中加入適量的NaOH溶液,產生藍色沉淀,經過濾、洗滌、灼燒得3.20g黑色固體。
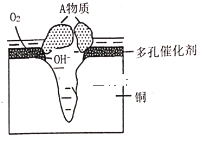
(1)該粉狀銹中除了銅元素外還含有(寫元素符號)_____元素.
(2)寫出該粉狀銹溶于稀硫酸反應的離子方程式____。
(3)加熱條件下,實驗②中所得的黑色固體能與乙醇反應,化學方程式為_____。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列各離子方程式中,屬于水解反應的是
A.HCO3-+H2O ![]() H3O++CO32-
H3O++CO32-
B.CH3COO-+H2O![]() CH3COOH+OH-
CH3COOH+OH-
C.PO43-+H3O+ ![]() HPO42-+H2O
HPO42-+H2O
D.H2O+H2O![]() H3O++OH-
H3O++OH-
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】(1)Na2O2__________(填“是”或“否”)屬于堿性氧化物,Na2O2是______色固體粉末。向包有Na2O2固體的棉花上滴幾滴水,棉花很快燃燒起來,原因是該反應有氧氣生成且該反應為__________(填”吸熱”或者“放熱”)反應;
(2)Na2O2作為在潛水艇和消防員呼吸面具中的供氧劑,寫出其中一個反應的化學方程式_________,某潛水艇中有50人,若每人每小時消耗O2在標準狀況下的體積為44.8L,假設所需要的O2全由Na2O2所提供,則每小時所需Na2O2的質量為________Kg。
(3)3.1gNa2O溶于水配成1L溶液,溶液中Na+離子物質的量濃度為________
(4)制備Fe(OH)3膠體:用潔凈的燒杯取一定量蒸餾水,用酒精燈加熱至沸騰,向燒杯中加入幾滴飽和FeCl3溶液繼續加熱至液體呈透明的紅褐色。
①寫出制備Fe(OH)3膠體反應的離子方程式______________________________
②驗證制得的分散系是膠體的方法為_________________________________
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】一定溫度下,將足量的AgCl分別放入下列物質中,AgCl的溶解度由大到小的排列順序是
①20 mL 0.01 mol/L KCl溶液 ②30 mL 0.02 mol/L CaCl2溶液
③40 mL 0.03 mol/L HCl溶液 ④10 mL 蒸餾水⑤50 mL 0.05 mol/L AgNO3溶液
A. ①>②>③>④>⑤ B. ④>①>③>②>⑤
C. ⑤>④>②>①>③ D. ④>③>⑤>②>①
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】實驗室用干燥的HCl氣體和鐵粉在加熱無氧條件下制備無水![]() ,裝置如圖所示,熱電偶的作用是測定電爐內的溫度。
,裝置如圖所示,熱電偶的作用是測定電爐內的溫度。

下列說法錯誤的是( )
A.該方法的優點是制備的![]() 純凈
純凈
B.由實驗可以推出![]() 的沸點低于鐵粉的沸點
的沸點低于鐵粉的沸點
C.本實驗制備1 mol ![]() 需要通入2 mol HCl氣體
需要通入2 mol HCl氣體
D.純凈![]() 能夠被干燥的氧氣氧化為
能夠被干燥的氧氣氧化為![]() ,同時有
,同時有![]() 生成
生成
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】將4 mol A氣體和2 mol B氣體在2 L的容器中混合并在一定條件下發生如下反應:2A(g)+B(g)2C(g)。若經2 s時測得C的濃度為0.6 mol·L-1,填寫下列空白:
(1)用物質A表示反應的平均速率為_________。
(2)用物質B表示反應的平均速率為_________。
(3)2 s時物質A的轉化率為_________。
(4)2 s時物質B的體積分數為_________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列實驗裝置設計正確且能達到實驗目的的是
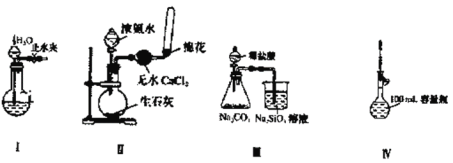
A.實驗裝置Ⅰ:檢查裝置的氣密性
B.實驗裝置Ⅱ:制取收集氨氣
C.實驗裝置Ⅲ:比較氯、碳、硅三種元素的非金屬性強弱
D.實驗裝置Ⅳ:定容
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com