
【題目】Ⅰ (1)下列實驗操作或敘述正確的是_________(填字母)
A.向飽和苯酚鈉溶液中,不斷通入足量二氧化碳氣體,溶液最終呈渾濁
B.用金屬鈉檢驗無水乙醇中含有的少量水
C.在催化劑存在的條件下,苯和溴水發生反應可生成無色比水重的液體溴苯
D.向苯酚濃溶液中滴入少量濃溴水可觀察到白色的三溴苯酚沉淀
E.只用水就能鑒別苯、硝基苯、乙醇
F.將10滴溴乙烷加入1mL10%的燒堿溶液中加熱片刻后,再滴加2滴2%的硝酸銀溶液,以檢驗水解生成的溴離子
G.將銅絲彎成螺旋狀,在酒精燈上加熱變黑后,立即伸入盛有無水乙醇的試管中,完成乙醇氧化為乙醛的實驗
H.甲醛與苯酚制取酚醛樹脂的反應屬于縮聚反應
I.在蔗糖的水解液中加新制Cu(OH)2懸濁液,有磚紅色沉淀生成
Ⅱ. 1—乙氧基萘常用作香料,也可合成其他香料。實驗室制備1—乙氧基萘的過程如下:
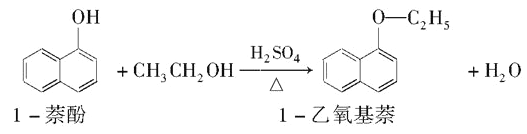
已知:1—苯酚的性質與苯酚相似,有難聞的苯酚氣味。相關物質的物理常數如下:
物質 | 相對分子質量 | 狀態 | 熔點 (℃) | 沸點 (℃) | 溶解度 | |
水 | 乙醇 | |||||
1-萘酚 | 144 | 無色或黃色菱形結晶或粉末 | 96℃ | 278℃ | 微溶于水 | 易溶于乙醇 |
1-乙氧基萘 | 172 | 無色液體 | 5.5℃ | 267℃ | 不溶于水 | 易溶于乙醇 |
乙醇 | 46 | 無色液體 | -114.1℃ | 78.5℃ | 任意比混溶 | |
(1) 將72g1-萘酚溶于100mL無水乙醇中,加入5mL濃硫酸混合。將混合液置于如圖所示的容器中加熱充分反應(加熱裝置和其它加持裝置未畫出)。實驗中使用過量乙醇的原因是____________________。

(2)裝置a的作用是________________。
(3)反應結束,將三頸燒瓶中的液體倒入冷水中,經處理得到有機層。為提純產物有以下四步操作:①蒸餾;
A.③②④① B.①②③④ C.②①③④
(4)蒸餾時應該選擇_________(選填編號),操作中應控制的關鍵實驗條件為________________。

(5)實驗測得1-乙氧基萘的產量與反應時間、溫度的變化如圖所示,時間延長、溫度升高,1-乙氧基萘的產量下降的原因是____________________。

(6)用金屬鈉可檢驗1—乙氧基萘是否純凈,簡述實驗現象與結論:_______________。
(7)提純的產品經測定為73.1g,本實驗中1—乙氧基萘的產率為________________。
【答案】 A E G H 提高1-萘酚的轉化率 使揮發出的乙醇冷卻后回流到三頸燒瓶中,從而提高乙醇原料的利用率 A ①③⑤⑥⑦ 控制溫度在267℃ 1-萘酚被氧化,溫度高乙醇大量揮發或溫度高發生副反應 加入金屬鈉有氣泡生成則產物不純,無氣泡生成則產物純凈 85.0%
【解析】Ⅰ.(1) A、向飽和苯酚鈉溶液中,不斷通入足量二氧化碳氣體,溶液最終呈渾濁,產生苯酚,選項A正確;B、乙醇和水都可與鈉反應,應用無水硫酸銅檢驗,選項B錯誤;C、在催化劑存在的條件下, 苯和液溴發生反應可生成無色、比水重的液體溴苯,選項C錯誤;D、向苯酚濃溶液中滴入少量濃溴水,會發生反應,產生白色的三溴苯酚沉淀,但是該沉淀會溶于苯酚中,選項D錯誤;E、乙醇與水任意比互溶,苯和硝基苯不溶于水,但苯的密度比水小,硝基苯的密度比水大,可鑒別,選項E正確;F、 檢驗溴代烴水解生成的溴離子的方法:加強堿溶液使溶液呈堿性,再加硝酸酸化,再加硝酸銀,若產生淺黃色沉淀則含有溴原子,選項F錯誤;G、乙醇在銅做催化劑的條件下發生氧化反應生成乙醛,選項G正確;H、甲醛與苯酚制取酚醛樹脂的反應屬于縮聚反應,選項H正確;I、新制Cu(OH) 2 懸濁液與葡萄糖反應生成磚紅色沉淀,此反應必須在堿性條件下發生,而蔗糖水解是用稀硫酸作催化劑,選項I錯誤。答案選AEGH。
Ⅱ. (1)使用過量的乙醇可提高1-萘酚的轉化率;(2)裝置a是冷凝管,其作用是:使揮發出的乙醇冷卻后回流到三頸燒瓶中,從而提高乙醇原料的利用率;(3)反應結束,燒瓶中液體含有1-乙氧基萘、1-萘酚、乙醇、硫酸和水,倒入冷水中經處理得到的有機層含有1-乙氧基茶、1-萘酚、乙醇,由于1-萘酚的性質與苯酚相似,與NaOH溶液發生反應生成易溶于水的鈉鹽,而1-乙氧基萘、乙醇都不能與NaOH溶液反應,因此先加入過量NaOH溶液除去1-萘酚,再水洗并分液,得到的有機層含有1-乙氧基萘、乙醇及少量水,然后用無水氯化鈣干燥,過濾所得濾液含有1-乙氧基茶和乙醇,最后用蒸餾法分離1-乙氧基萘和乙醇(兩者沸點相差較大),得到純凈的1-乙氧基萘,故A正確;(4)蒸餾時應該選擇蒸餾燒瓶、溫度計、直形冷凝管、牛角管、錐形瓶,即①③⑤⑥⑦;產品1-乙氧基萘的沸點是267℃,操作中應控制的關鍵實驗條件為控制溫度在267℃;(5)實驗測得1-乙氧基萘的產量與反應時間、溫度的變化如圖所示,時間延長、溫度升高,1-乙氧基萘的產量下降的原因是:1-萘酚被氧化,溫度高乙醇大量揮發或溫度高發生副反應;(6) 1—乙氧基萘不能與鈉反應,加入金屬鈉有氣泡生成則產物不純,無氣泡生成則產物純凈;(7)根據反應方程式可知,生成1mol1—乙氧基萘,72g1-萘酚反應理論上應該生成86g1—乙氧基萘,提純的產品經測定為73.1g,本實驗中1—乙氧基萘的產率為: ![]() 。
。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小學生10分鐘應用題系列答案
小學生10分鐘應用題系列答案科目:高中化學 來源: 題型:
【題目】某研究小組利用海水提取粗鹽后得到的苦鹵(含Mg2+、Ca2+、Br-等離子的溶液)提取Br2并制備含鎂化合物。部分工藝流程設計如下:

回答下列問題:
(1)步驟I中用硫酸酸化可抑制氯氣與水的反應,原因是____(結合離子方程式回答)。
(2)工業上常用Na2CO3法或SO2法實現含Br2混合氣到液溴的轉化,流程如下:
Na2CO3法:
![]()
SO2法:
![]()
① Na2CO3法中步驟Ⅲ的反應有氣體生成,離子方程式為______。步驟V中蒸餾時蒸氣出口溫度通常控制在65-75℃,若溫度過低,溴蒸出不充分;若溫度過高,則會導致液溴中混有較多的____________。
② SO2法對比Na2CO3法的缺點是__________(答出一條即可)。
(3)提溴后所得含Mg2+、Ca2+的溶液可設計如下流程制各堿式碳酸鎂[Mg5(OH)2(CO3)4·4H2O]和無水氯化鎂:

① 步驟Ⅷ的化學方程式為_________。
② 若步驟X中生成的CO與CO2物質的量之比為3:1,寫出反應的化學方程式__________。
③25℃,步驟Ⅵ生成Mg(OH)2沉淀后,若溶液中殘留的Mg2+濃度為l.8×10-6mol/L 。則溶液的pH為________;此pH下,欲使Mg(OH)2沉淀中不含Ca(OH)2,則溶液中c(Ca2+)不能大于____(已知:25℃時,Ksp[Mg(OH)2]=1.8×10-11,Ksp[Ca(OH)2]=5.5×10-6)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列變化不能說明發生了化學變化的是( )
A.變化時有電子的得失或共用電子對的形成
B.變化過程中有舊化學鍵的斷裂和新化學鍵形成
C.變化時釋放出能量
D.變化前后原子的種類和數目沒有改變,分子種類增加了
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】如圖所示的過程是目前直接利用太陽能的研究熱點。人們把通過人工光化學手段合成燃料的過程叫做人工光合作用。

(1)在上圖構想的物質和能量循環中太陽能最終轉化為____________能。
(2)人工光合作用的途徑之一就是在催化劑和光照條件下,將CO2和H2O轉化為CH3OH,該反應的化學方程式為:2CO2(g)+4H2O(g)![]() 2CH3OH(g)+3O2(g)。
2CH3OH(g)+3O2(g)。
一定條件下,在2L密閉容器中進行上述反應,測得n(CH3OH)隨時間的變化如下表所示:
時間/min | 0 | 1 | 2 | 3 | 4 | 5 | 6 |
n(CH3OH)/mol | 0.000 | 0.040 | 0.070 | 0.090 | 0.100 | 0.100 | 0.100 |
①用CH3OH表示0~3 min內該反應的平均反應速率為______________________。
②能說明該反應已達到平衡狀態的是_______________。
a.v正(H2O)=2v逆(CO2)
b.n(CH3OH) :n(O2)=2 :3
c.容器內密度保持不變
d.容器內壓強保持不變
(3)用人工光合作用得到的甲醇、氧氣和稀硫酸制作燃料電池,則甲醇應通入該燃料電池的____極(填“正”或“負”),通入氧氣的一極的電極反應式為_______________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列實驗操作錯誤的是
A. 稀釋濃硫酸時,將水沿器壁慢慢注入酸中
B. 點燃氫氣前,先檢驗氫氣的純度
C. 加熱液體時,試管口不對著人
D. 利用丁達爾效應區別膠體和溶液
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某無色透明的溶液,在酸性和堿性的條件下都能大量共存的是( )
A. Fe2+、K+、SO42-、NO3- B. Mg2+、NH4+、SO42-、Cl-
C. Na+、K+、SO42-、NO3- D. Ba2+、Na+、MnO4- 、SO42-
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】以原油為原料生產聚烯烴的幾個步驟如下:

(1)步驟①使用的方法是分餾。分餾是利用原油中各組分的________不同進行分離的過程。
(2)步驟③中,聚烯烴的合成反應與聚乙烯的相同,該反應類型是__________。
生產的聚丙烯可表示為:
其重復結構單元即它的鏈節是_______________。
(3)乙烯是一種重要的基本化工原料,可制備乙酸乙酯,其轉化關系如下。

已知:H2C=CH—OH不穩定
I. 反應生成的乙酸乙酯的過程中,用飽和碳酸鈉的作用是:____________________。
Ⅱ.①的化學反應方程式是____________________________________。
Ⅲ. ④的化學反應方程式是____________________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】將適量金屬鈉投入下列溶液中,有氣體放出,但無沉淀生成的是( )
A. 鹽酸 B. 飽和氫氧化鈉溶液 C. FeCl3溶液 D. CuSO4溶液
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com