
【題目】既能跟鹽酸反應,又能跟氫氧化鈉溶液反應的物質是
A. CuSO4 B. MgO C. NaHCO3 D. Fe(OH)3
科目:高中化學 來源: 題型:
【題目】根據題目要求填空:
(1)硫、氮的氧化物是主要的大氣污染物,對大氣的影響之一是導致酸雨.用化學方程式表示NO2形成酸雨的原因: , 該反應中氧化劑和還原劑的物質的量之比為 .
(2)實驗室常用的幾種氣體發生裝置如圖1A、B、C所示: 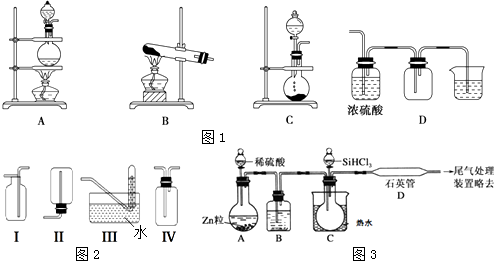
實驗室可以用B或C裝置制取氨氣,如果用B裝置,反應的化學方程式是;如果用C裝置,通常使用的藥品是(寫名稱);圖2是某學生設計收集氨氣的幾種裝置,其中可行的是 . 若用A裝置與D裝置相連制取并收集X氣體,則X可能是下列氣體中的
A.CO2 B.NO C.Cl2 D.H2
寫出A裝置中反應的離子方程式 .
(3)氫化鈉(NaH)是一種還原性極強的物質,廣泛應用于工業生產.
氫化鈉(NaH)中Na元素的化合價為+1,在高溫下氫化鈉(NaH)可將四氯化鈦(TiCl4)還原成金屬鈦,該反應的化學方程式為 .
NaH能與水劇烈反應:NaH+H2O═NaOH+H2↑,NaH與液氨(NH3)也有類似反應,該反應的化學方程式為 . 如果有12g NaH參加此反應,則轉移電子的物質的量為mol
(4)用SiHCl3與過量H2反應制備純硅的裝置如圖3所示(熱源及夾持裝置均已略去):
SiHCl3遇水劇烈反應生成H2SiO3、HCl和另一種物質,寫出配平的化學反應方程式:;H2還原SiHCl3過程中若混入O2 , 可能引起的后果是 .
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列有關化學鍵與晶體結構說法正確的是
A.兩種元素組成的分子中一定只有極性鍵
B.離子化合物的熔點一定比共價化合物的高
C.非金屬元素組成的化合物一定是共價化合物
D.含有陰離子的化合物一定含有陽離子
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】NaCl是重要的化工原料,可以制備一系列物質.有關下列流程的說法中,正確的是( ) 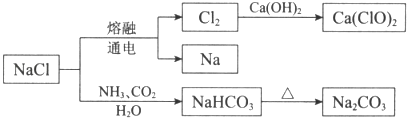
A.NaHCO3的熱穩定性好
B.如圖所示轉化涉及的反應都是氧化還原反應
C.常溫下干燥的Cl2能用鋼瓶貯存,所以Cl2不與鐵反應
D.石灰乳與Cl2的反應中,Cl2既是氧化劑,又是還原劑
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】硼及其化合物廣泛應用于高新材料領域,請回答下列有關問題:
(1)晶體硼的結構單元是正二十面體,每個單元中有12個硼原子(如圖)。
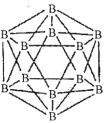
①在基態11B原子中,核外存在______對自旋相反的電子。
②若每個單元中有兩個原子為l0B,其余為11B,則該單元結構的類型有______種。
(2)NaBH4是一種重要的儲氫載體,其中涉及元素的電負性由小到大的順序為________,BH4-離子的空間構型是_____________,與BH4-互為等電子體的的分子有___________。
(3)硼酸(H3BO3)為白色片狀晶體,有與石墨相似的層狀結構,則硼酸晶體中存在的作用力有共價鍵、_____、_______。與H3BO3酸性最接近的是__________(填字母)。
A.H4SiO4 B.H3PO4 C.HNO2
(4)磷化硼是一種受到高度關注的耐磨涂料,它可用作金屬的表面保護層。如圖是磷化硼晶體的晶胞,B原子的雜化方式是___________。立方相氮化硼晶體的熔點要比磷化硼體高,其原因是_____________。
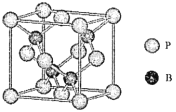
(5)己知磷化硼的晶胞參數a=478 pm,請列式計算該晶體的密度p=_____g.cm-3(用含NA的代數式表示即可,不需要計算出結果)。晶胞中硼原子和磷原子最近的核間距為_________pm。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列敘述正確的是( )
A. 95 ℃純水的pH<7,說明加熱可導致水呈酸性
B. pH=3的鹽酸溶液,加水稀釋至溶液體積為原來體積10倍后pH=4
C. pH=1的鹽酸與等體積pH=3的鹽酸混合后pH=2
D. pH=3的醋酸溶液與pH=11的氫氧化鈉溶液等體積混合后pH=7
查看答案和解析>>
科目:高中化學 來源: 題型:
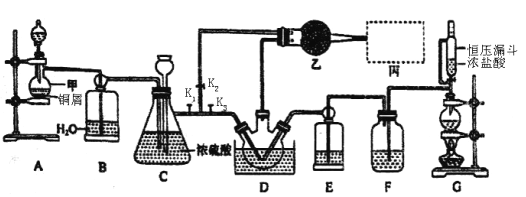
【題目】亞硝酰氯(NOCl)是有機合成中ffi重要試劑,可由NO與Cl2在常溫常壓(或稍低溫度)下合成,其熔點-64.5℃,沸點-5.5℃,遇水易水解。實驗室模擬制備裝置如圖所示(部分夾持裝置省略),D中三頸燒瓶置于-10℃冰鹽水中。
經查閱資料:NO與NaOH溶液不反應,但NO2+NO+2NaOH =2NaNO2+H2O
(1)儀器甲的名稱是________。
(2)圖示裝置中恒壓漏斗與分液漏斗相比,其優點為___________。
(3) NOC1分子中各原子均滿足8電子穩定結構,則NOCl的電子式為_________。
(4)實驗開始時,先打開K1、K2,關閉K3,打開分液漏斗活塞滴入適量稀硝酸,至C中紅棕色完全消失后,關閉K1、K2,此時裝置C的作用為___________。滴入適量濃鹽酸,點燃酒精燈,當_______(填裝置符號)中充滿黃綠色氣體時,打開K1、K3,制備NOC1。
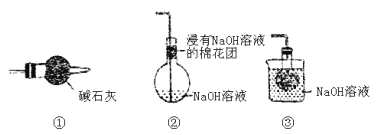
(5)裝置乙中裝有無水CaCl2,其作用為_______;丙為尾氣處理裝置,則最佳選擇為_____。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com