
硫酸工業尾氣中二氧化硫的含量超過0.05%(體積分數)時必需經處理后才能排放。某校化學興趣小組欲測定某硫酸工廠排放尾氣中二氧化硫的含量,分別采用以下方案:
【甲方案】如下圖所示,圖中氣體流量計B用于準確測量通過的尾氣體積。將尾氣通入一定體積已知濃度的碘水中測定SO2的含量。當洗氣瓶C中溶液藍色消失時,立即關閉活塞A。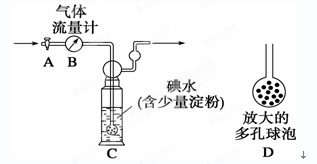
(1)洗氣瓶C中導管末端連接一個多孔球泡D,其目的是______________________________。
(2)洗氣瓶C中的溶液還可以用其他試劑代替,如酸性高錳酸鉀溶液,你認為選擇酸性高錳酸鉀溶液的理由有________________________________________________________。
(3)洗氣瓶C中溶液藍色消失后,若沒有及時關閉活塞A,則測得的SO2含量____________(填“偏高”、“偏低”或“無影響”)。若某實驗小組同學測得的SO2含量總是偏低,可能的原因是__________________________________________________。(假設實驗裝置、測量儀器、藥品和實驗操作程序均合理)
【乙方案】:實驗步驟如下面流程圖所示: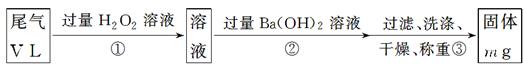
(4)寫出步驟②中反應的化學方程式____________________________________________。
(5)步驟③中判斷沉淀已經洗滌干凈的方法是_______________________________________。
(6)實驗中若通過的尾氣體積為33.6L (已換算成標準狀況),最終所得固體質量為0.233g,試通過計算確定該尾氣中二氧化硫的含量是否達到排放標準(寫出計算過程)。
(10分)(1)增大氣體與溶液的接觸面積,有利于SO2與碘水充分反應(1分)
(2)酸性高錳酸鉀溶液能夠充分吸收SO2并與之反應,反應終了時現象易于觀察(或其他合理答案)(1分) (3)偏低 通入尾氣速率過快,SO2吸收不充分(各1分)
(4)H2SO4+Ba(OH)2=BaSO4↓+2H2O(2分)
(5)取最后一次的洗滌液少許,用PH試紙測量PH值或加入Na2SO4溶液,看是否有渾濁出現(或其他合理答案)(2分)
(6)由硫守恒可知n(SO2)=n(BaSO4)="0.001" mol,得到SO2的體積分數為0.067%大于0.05%,未達標(2分)
解析試題分析:(1)多孔球泡D能增大氣體與溶液的接觸面積,有利于SO2與碘水充分反應。
(2)因為酸性高錳酸鉀溶液具有強氧化性,能夠充分吸收SO2并與之反應,且酸性高錳酸鉀溶液顯紫紅色,反應終了時現象易于觀察。
(3)洗氣瓶C中溶液藍色消失后,若沒有及時關閉活塞A,則導致通過的氣體偏多,因此測得的SO2含量偏低。測得的SO2含量總是偏低,可能的原因是通入尾氣速率過快,SO2吸收不充分引起的。
(4)雙氧水具有氧化性,能把SO2氧化生成硫酸,所以反應②的化學方程式是H2SO4+Ba(OH)2=BaSO4↓+2H2O。
(5)步驟③中判斷沉淀已經洗滌干凈的方法可以是沉淀法,也可以通過測量溶液的pH值,即取最后一次的洗滌液少許,用PH試紙測量PH值或加入Na2SO4溶液,看是否有渾濁出現(或其他合理答案)。
(6)最終所得固體是硫酸鋇,其質量為0.233g,物質的量是0.233g÷233g/mol=0.001mol。又因為尾氣的物質的量是33.6L÷22.4L/mol=1.5mol
所以該尾氣中二氧化硫的含量是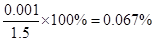
即SO2的體積分數大于0.05%,未達標
考點:考查SO2尾氣吸收的綜合性實驗判斷
點評:該題是中等難度的試題,也是高考中的常見考點,試題綜合性強,側重能力的培養和實驗設計能力的訓練,難度較大,學生不易得分。該類試題綜合性強,理論和實踐的聯系緊密,有的還提供一些新的信息,這就要求學生必須認真、細致的審題,聯系所學過的知識和技能,進行知識的類比、遷移、重組,全面細致的思考才能得出正確的結論。


科目:高中化學 來源: 題型:


 Fe(OH)3+3H+ 2H++CaCO3=Ca2++CO2↑+H2O
Fe(OH)3+3H+ 2H++CaCO3=Ca2++CO2↑+H2O Fe(OH)3+3H+ 2H++CaCO3=Ca2++CO2↑+H2O
Fe(OH)3+3H+ 2H++CaCO3=Ca2++CO2↑+H2O Mn3O4+SO2↑+2SO3↑+3H2O
Mn3O4+SO2↑+2SO3↑+3H2O Mn3O4+SO2↑+2SO3↑+3H2O
Mn3O4+SO2↑+2SO3↑+3H2O查看答案和解析>>
科目:高中化學 來源: 題型:
| n(SO32-) |
| n(HSO3-) |
|
91:9 | 1:1 | 9:91 | ||
| 室溫下pH | 8.2 | 7.2 | 6.2 |
| n(SO32-) |
| n(HSO3-) |
查看答案和解析>>
科目:高中化學 來源: 題型:
釩(V)及其化合物在工業催化、新材料和新能源等領域中有廣泛的應用,其中接觸法制硫酸工業中就要用到V2O5作催化劑:
2SO2(g)+O2(g) 2SO3(g) ΔH<0。
某溫度下,將2mol SO2和1mol O2置于10 L密閉容器中,在V2O5作催化劑下經5min反應達平衡,SO2的平衡轉化率(α)為80%。
(1)5min內 v(SO3 )= mol·L-1·min-1
(2)該溫度下平衡常數K=
(3)若縮小容器體積,至達到新的平衡,在圖中畫出反應速率變化圖象。
(4)硫酸工業尾氣SO2用濃氨水吸收,反應的離子方程式是 ,吸收后的產物最終可制成肥料硫銨[即(NH4)2SO4]。
(5)某含釩化合物及硫酸的電池是利用不同價態離子對的氧化還原反應來實現化學能和電能相互轉化的裝置,其原理如下圖所示。
①用該電池電解(NH4)2SO4溶液生產(NH4)2S2O8(過二硫酸銨)。電解時均用惰性電極,陽極電極反應式可表示為 ;若電解得1mol(NH4)2S2O8,則電池左槽中H+將 (填“增大”或“減少”) mol。
②電池使用一段時間后對其進行充電,充電過程中,陽電極反應式為: 。
查看答案和解析>>
科目:高中化學 來源:2012屆浙江省衢州二中高三下學期第一次綜合練習理科綜合試卷(化學部分) 題型:填空題
釩(V)及其化合物在工業催化、新材料和新能源等領域中有廣泛的應用,其中接觸法制硫酸工業中就要用到V2O5作催化劑:
2SO2(g)+O2(g)  2SO3(g) ΔH<0。
2SO3(g) ΔH<0。
某溫度下,將2 mol SO2和1 mol O2置于10 L密閉容器中,在V2O5作催化劑下經5min反應達平衡,SO2的平衡轉化率(α)為80%。
(1)5min內 v(SO3 )= mol·L-1·min-1
(2)該溫度下平衡常數K=
(3)若縮小容器體積,至達到新的平衡,在圖中畫出反應速率變化圖象。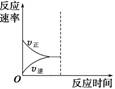
(4)硫酸工業尾氣SO2用濃氨水吸收,反應的離子方程式是 ,吸收后的產物最終可制成肥料硫銨[即(NH4)2SO4]。
(5)某含釩化合物及硫酸的電池是利用不同價態離子對的氧化還原反應來實現化學能和電能相互轉化的裝置,其原理如下圖所示。
①用該電池電解(NH4)2SO4溶液生產(NH4)2S2O8(過二硫酸銨)。電解時均用惰性電極,陽極電極反應式可表示為 ;若電解得1mol(NH4)2S2O8,則電池左槽中H+將 (填“增大”或“減少”) mol。
②電池使用一段時間后對其進行充電,充電過程中,陽電極反應式為: 。
查看答案和解析>>
科目:高中化學 來源:2013-2014學年上海市徐匯區高三上學期期末(一模)考試化學試卷(解析版) 題型:填空題
硫元素的含氧酸鹽在工業上用途廣泛,完成下列填空。
工業上用Na2SO3溶液處理工業尾氣中的SO2,下表數據表示反應過程中 隨pH變化的關系:
隨pH變化的關系:
|
|
91:9 |
1:1 |
9:91 |
|
室溫下pH |
8.2 |
7.2 |
6.2 |
(1)簡述 = 1時,溶液pH= 7.2的原因:___________________;若用0.20 mol/L 的NaOH溶液(反應前后溶液體積不變)吸收SO2,若反應后溶液呈中性,則
= 1時,溶液pH= 7.2的原因:___________________;若用0.20 mol/L 的NaOH溶液(反應前后溶液體積不變)吸收SO2,若反應后溶液呈中性,則
c (HSO3-) + 2c (SO32-) = _______ mol/L 。
(2)已知:Ki1(H2SO3)> Ki(HAc) > Ki2(H2SO3) > Ki2(H2CO3),要使NaHSO3溶液中c(Na+):c(HSO3-)接近1:1,可在溶液中加入少量____________。
a.H2SO3溶液 b.NaOH溶液 c.冰醋酸 d.Na2CO3
(3)實驗室通過低溫電解KHSO4溶液制備過二硫酸鉀K2S2O8,寫出熔融KHSO4的電離方程式:__________________________________________。
(4)S2O82-有強氧化性,還原產物為SO42-,硫酸錳(MnSO4)和過硫酸鉀(K2S2O8)兩種鹽溶液在銀離子催化下可發生反應,得到紫紅色溶液。書寫此反應的化學方程式: 。
(5)已知:S2O32-有較強的還原性,實驗室可用I-測定K2S2O8樣品的純度:反應方程式為:
S2O82-+2I-→2SO42-+I2 ……① I2+2S2O32-→2I-+S4O62- ……②
S2O82-、S4O62-、I2氧化性強弱順序:__________________________。
(6)K2S2O8是偏氟乙烯(CH2=CF2)聚合的引發劑,偏氟乙烯由CH3—CClF2氣體脫去HCl制得,生成0.5 mol偏氟乙烯氣體要吸收54 kJ的熱,寫出反應的熱化學方程式_______。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com