
【題目】設NA為阿伏伽德羅常數的值,下列說法正確的是
A. 電解精煉銅時轉移了NA個電子,陽極溶解了32g銅
B. 1mol FeCl3完全水解后可生成NA個氫氧化鐵膠粒
C. 常溫下,1mol氯氣通入足量水中發生反應轉移的電子數為NA
D. 100mL 0.1mol/L Na2CO3溶液中含有的陰離子數目大于0.01NA
【答案】D
【解析】
A.電解精煉銅時每轉移NA個電子,轉移了1mol電子;由于粗銅中含有較活潑的雜質Fe、Zn等,電解時雜質優先放電,所以陽極溶解的銅小于0.5mol,溶解的銅的質量小于32g,故A錯誤;
B.氫氧化鐵膠體是很多氫氧化鐵膠粒的聚合體,所以1mol FeCl3完全水解生成氫氧化鐵膠粒個數小于NA,故B錯誤;
C. 常溫下,氯氣和水反應為可逆反應,因此1mol氯氣通入足量水中發生反應轉移的電子數小于NA,故C錯誤;
D. 100mL 0.1mol/L Na2CO3溶液中,碳酸根離子少量水解:CO32-+H2O![]() HCO3-+OH-,陰離子增多,溶液中的陰離子數目大于0.01NA;故D正確;
HCO3-+OH-,陰離子增多,溶液中的陰離子數目大于0.01NA;故D正確;
綜上所述,本題選D。


 天天向上口算本系列答案
天天向上口算本系列答案科目:高中化學 來源: 題型:
【題目】(1)已知:2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g) ΔH1 ;
2CH3OH(g)+3O2(g)=2CO2(g)+4H2O(g) ΔH2,
則ΔH1______ΔH2;(填“> ”、“< ”或“=”)
(2)已知:H2(g)+Cl2(g)===2HCl(g)ΔH=-185 kJ·mol-1,查閱資料可知:H—H鍵能:436 kJ·mol-1、Cl—Cl鍵能:243 kJ·mol-1,則H—Cl鍵能=______________;
(3)在298K、100kPa時,已知:2H2(g)+O2(g)==2H2O(g) ΔH1 ;2HCl(g)==Cl2(g)+H2(g) ΔH2 ;2Cl2(g)+2H2O(g)==4HCl(g)+O2(g)ΔH3 , 則ΔH3與ΔH1和ΔH2的關系是:ΔH3=_______________;
(4)消除氮氧化物的污染對環境至關重要,用CH4催化還原NOx可以消除氮氧化物的污染。已知一定條件下:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) △H=-574 kJ·mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) △H=-1160 kJ·mol-1
則該條件下,用CH4還原NO2至N2的熱化學方程式為:_________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】25℃時,將濃度均為0.1mol/L、體積分別為Va和Vb的HA溶液與BOH溶液按不同體積比混合,保持Va+Vb=100nL,Va、Vb與混合液的p的關系如圖所示。下列說法正確的是

A. Ka(HA)=Kb(BOH)=1×10-6B. b點時,c(A-)=c(B+)=c(H+)=c(OH-)
C. c點時,c(A-)>c(B+)D. a→c過程中![]() 不變
不變
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】分析圖,甲、乙具有的共性是
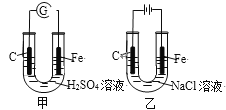
A. 反應物能量均高于生成物能量
B. 電極反應均有Fe-2e→Fe2+
C. 碳棒上均發生氧化反應
D. 溶液pH均增大
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】凈化汽車尾氣對于保護環境意義重大。其中的一個反應原理為:2NO(g)+2CO(g) ![]() N2(g)+2CO2(g)+Q(Q>0)。
N2(g)+2CO2(g)+Q(Q>0)。
回答下列問題:
(1)一定溫度下,將等物質的量的NO和CO通入固定容積為4L的密閉容器中,反應過程中部分物質的物質的量變化如圖所示,則0~20min平均反應速率v(NO)為_____________。

(2)如圖所示,若Y表示平衡常數,只改變某一反應條件X,反應由平衡I達到新平衡Ⅱ,則條件X為_______________,NO的轉化率為平衡I_________平衡Ⅱ(填:“大于”、“小于”或“不變”)

(3).能判斷該反應達到平衡狀態的標志是_______________(選填編號)
a.v生成(CO2)=v消耗(CO) b.混合氣體的平均相對分子質量不再改變
c.平衡常數保持不變 d.NO、CO、N2、CO2的濃度均不再變化

(4).在t2時刻,將容器的容積迅速擴大到原來的2倍,在其他條件不變的情況下,t3時刻達到新的平衡狀態。請在上圖中,補充畫出從t2到t4時刻正反應速率隨時間的變化曲線________ 。
(5).三聚氰酸[C3N3(OH)3]可用于消除汽車尾氣中的NO2,其反應分兩步進行。第一步是:C3N3(OH)3![]() 3HCNO;第二步是HCNO與NO2反應,把氮元素和碳元素轉變成無毒氣體。請寫出第二步發生的化學反應方程式______________________________________,每消除1mol NO2轉移電子_________個。
3HCNO;第二步是HCNO與NO2反應,把氮元素和碳元素轉變成無毒氣體。請寫出第二步發生的化學反應方程式______________________________________,每消除1mol NO2轉移電子_________個。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】用化學用語表示Na2CO3+2Cl2===2NaCl+Cl2O+CO2中的相關微粒,其中正確的是( )
A. Na+的結構示意圖:![]()
B. Cl2O的結構式:Cl—O—Cl
C. 中子數比質子數多3的氯原子:3517Cl
D. CO2的電子式:![]()
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列說法正確的是( )
A. 甲醇燃料電池工作時,甲醇得到電子,發生還原反應
B. 室溫下,稀釋0.1 mol·L-1氨水,c(H+)·c(NH3·H2O)的值減小
C. 將1 mol Cl2通入水中,HClO、Cl-、ClO-粒子數之和為2×6.02×1023
D. SiO2(s)+2C(s)===Si(s)+2CO(g)在常溫下不能自發進行,則該反應的ΔH<0
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】[實驗化學]
8羥基喹啉(![]() )是白色或淡黃色粉末,可通過如下實驗步驟制得:
)是白色或淡黃色粉末,可通過如下實驗步驟制得:
①如圖所示,在三頸燒瓶中加入適量甘油、鄰硝基苯酚、鄰氨基苯酚和濃硫酸。

②加熱至反應自動激烈進行。
③改為水蒸氣蒸餾裝置進行水蒸氣蒸餾,直至餾出液中不再有油珠為止。
④向三頸燒瓶中加入一定量NaOH溶液后,再滴加飽和Na2CO3溶液將pH調至7~8。
⑤重新進行水蒸氣蒸餾,至餾出液中不再有晶體析出。
⑥將餾出液充分冷卻后抽濾,進一步精制得產品。
(1)上圖中冷卻水應從________(填“A”或“B”)口進。

(2)上圖是水蒸氣發生裝置。第一次水蒸氣蒸餾的目的是___________________________________;當冷凝管出現堵塞時,圖中可觀察到的現象是_________________________________________。
(3)抽濾裝置中,布氏漏斗進入抽濾瓶的部分不宜過長,其原因是________________________________。
(4)步驟②中移開火源,反應仍自動激烈進行的原因是__________________________________。
(5)步驟④中加入的飽和Na2CO3溶液不能過量的原因是__________________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】聚合硫酸鐵(簡稱PFS或聚鐵)是水處理中重要的絮凝劑。以黃鐵礦的燒渣(主要成分為Fe2O3、FeO、SiO2等)為原料制取聚合硫酸鐵(![]() )的工藝流程如下:
)的工藝流程如下:
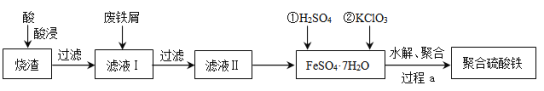
(1)酸浸時最合適的酸是_____(寫化學式)。
(2)酸浸后溶液中主要的陽離子有_____。
(3)加入KClO3的目的是_____________________________(結合離子方程式說明)。
(4)過程a中生成聚合硫酸鐵的過程是先水解再聚合。將下列水解反應原理的化學方程式補充完整。
_____Fe2(SO4)3+_____H2O![]() ______Fe2(OH)x(SO4)3-
______Fe2(OH)x(SO4)3-![]() + _____ ______
+ _____ ______
(5)過程a中水解要嚴控pH的范圍。pH偏小或偏大聚合硫酸鐵的產率都會降低,請解釋原因__________。
(6)鹽基度B是衡量絮凝劑絮凝效果的重要指標,通常鹽基度越高,絮凝效果越好。鹽基度B的表達式:![]() (n為物質的量)。為測量聚合硫酸鐵的鹽基度,進行如下實驗操作:
(n為物質的量)。為測量聚合硫酸鐵的鹽基度,進行如下實驗操作:
ⅰ.取聚合硫酸鐵樣品m g,加入過量鹽酸,充分反應,再加入煮沸后冷卻的蒸餾水,再加入KF溶液屏蔽Fe3+,使Fe3+不與OH-反應。然后以酚酞為指示劑,用c mol/L的標準NaOH溶液進行中和滴定,到終點時消耗NaOH溶液V mL。
ⅱ.做空白對照實驗,取與步驟ⅰ等體積等濃度的鹽酸,以酚酞為指示劑,用c mol/L的標準NaOH溶液進行中和滴定,到終點時消耗NaOH溶液V0 mL。
①該聚合硫酸鐵樣品中n(OH-) =_________mol。
②已知該樣品中Fe的質量分數w,則鹽基度B=_______________。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com