
(10分)將一定量的SO2和含0.7mol氧氣的空氣(忽略CO2)放入0.5 L密閉容器內,550℃時,在催化劑作用下發生反應: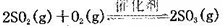 (正反應放熱)。測得n(O2)隨時間的變化如下表
(正反應放熱)。測得n(O2)隨時間的變化如下表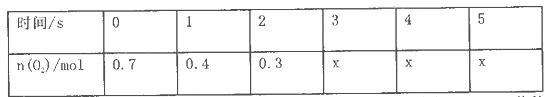
反應達到5s后,將容器中的混合氣體通過過量NaOH溶液,氣體體積減少了22. 4L(此體積為標準狀況下的體積);再將剩余氣體通過焦性沒食子酸的堿性溶液吸收O2,氣體的體積又減少了5.6L(此體積為標準狀況下的體積)。
請回答下列問題:
(1)用O2表示從0-ls內該反應的平均反應速率為__________________。
(2)O2的平衡濃度c (O2)=____________________________;
(3) 4s時,SO2的生成速率____________(填“大于”、“小于”或“等于”)O2的消耗速率。
(4)求該反應達到平衡時SO2的轉化率是________(用百分數表示)。
(5)若將平衡混臺氣體中SO3的5%通入過量的BaCl2溶液,生成沉淀_______克(計算結果保留一位小數)。
(1)0.6mol/(L·s)
(2)0.5mol/L
(3)大于
(4)90%
(5)10.5
解析試題分析:(1)0-ls內O2的物質的量減少0.7-0.4=0.3mol,濃度減少0.3mol/0.5L=0.6mol/L,所以用O2表示從0-ls內該反應的平均反應速率為0.6mol/L/1s=0.6mol/(L·s)
(2)根據題意可知,與氫氧化鈉的反應的是二氧化硫、三氧化硫的混合氣體,二者的物質的量之和與開始加入的二氧化硫的物質的量相同,所以混合氣體通過氫氧化鈉溶液體積減少(標準狀況)22.4L,說明開始通入的二氧化硫的物質的量是1mol,剩余氣體通過焦性沒食子酸的堿性溶液吸收O2,氣體的體積又減少了5.6L(標準狀況),說明剩余氧氣5.6L,物質的量是0.25mol,濃度是5.6L/22.4L/mol/0.5L=0.5mol/L,所以壓強的平衡濃度是0.5mol/L;
(3)4s時,反應已達平衡,v逆(SO2)=2v正(O2),所以SO2的生成速率大于O2的消耗速率。
(4)氧氣的平衡物質的量是0.25mol,則消耗氧氣0.7mol-0.25mol=0.45mol,所以消耗二氧化硫0.45mol×2=0.9mol,根據(2)的分析可知,二氧化硫的初始量是1mol,所以該反應達到平衡時SO2的轉化率是0.9mol/1mol×100%=90%;
(5)混合氣體中的三氧化硫與BaCl2溶液反應生成硫酸鋇沉淀。同理可計算出生成三氧化硫的物質的量是0.9mol,其5%與BaCl2溶液反應,生成硫酸鋇0.045mol,質量是10.485g,保留一位小數是10.5g。
考點:考查二氧化硫的催化氧化反應,反應速率的計算與判斷,化學反應的有關計算


 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源: 題型:單選題
將H2(g)和Br2(g)充入恒容密閉容器,恒溫下發生反應H2(g)+Br2(g)  2HBr(g)△H<0,平衡時Br2(g)的轉化率為a;若初始條件相同,絕熱下進行上述反應,平衡時Br2(g)的轉化率為b。a與b的關系是
2HBr(g)△H<0,平衡時Br2(g)的轉化率為a;若初始條件相同,絕熱下進行上述反應,平衡時Br2(g)的轉化率為b。a與b的關系是
| A.a>b | B.a=b | C.a<b | D.無法確定 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
(共4分)在一個固定體積為2升的密閉容器中,充入2molA和1molB, 發 生如下反應: 2A(g)+B(g) 3C(g)+D(s),2分鐘反應達到平衡,此時C的濃度為1.2 mol/L。
3C(g)+D(s),2分鐘反應達到平衡,此時C的濃度為1.2 mol/L。
(1)2分鐘內用B表示的平均反應速度為 ;
(2)若容器溫度升高,平衡時混合氣體的平均相對摩爾質量減小,則正反應為: (填“吸熱”或“放熱”)反應。
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
用圖中所示實驗裝置證明氧化銅能加快約7%的雙氧水的分解并與二氧化錳的催化效果進行比較(即比較反應速率)。用圖示裝置測量產生氣體的體積,其他可能影響實驗的因素均已忽略,相關數據如下:
(1)從實驗原理來看,實驗中的“待測數據”可以指、也可以指 。
(2)實驗時氣體收集在B中,B儀器名稱是__________。若要檢驗產生的氣體是O2,待氣體收集結束 后,用彈簧夾夾住B下端乳膠管,打開單孔橡皮塞, 。
(3)為探究CuO在實驗②中是否起催化作用,除與①比較外,還需補做下列實驗不必寫具體步驟):a.證明CuO的化學性質沒有變化,b. 。
(4)為證明氧化銅的化學性質在加入雙氧水前后沒有發生改變,你設計驗證的實驗是 。
(5)實驗開始時,當往容器中加入一定量的雙氧水后,由于短時間內產生大量氣體,分液漏斗內的液體不能順利流下,為了解決這個問題,你采取的措施是 ;在測量生成的氣體體積時,除了要注意視線與凹液面相平以外,還應注意
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
(本題16分)
(1)為了減輕汽車尾氣造成的大氣污染,人們開始探索利用NO和CO在一定條件下轉化為兩種無毒氣體E和F的方法(已知該反應△H<0). 在2 L密閉容器中加入一定量NO和CO,當溫度分別在T1和T2時,測得各物質平衡時物質的量如下表:
 物質 物質T/℃ n/mol | NO | CO | E | F |
| 初始 | 0.100 | 0.100 | 0 | 0 |
| T1 | 0.020 | 0.020 | 0.080 | 0.040 |
| T2 | 0.010 | 0.010 | 0.090 | 0.045 |

 ΔH >0
ΔH >0| 序號 | 溫度 | 0 | 10 | 20 | 30 | 40 | 50 |
| ① | T1 | 0.050 | 0.0492 | 0.0486 | 0.0482 | 0.0480 | 0.0480 |
| ② | T1 | 0.050 | 0.0488 | 0.0484 | 0.0480 | 0.0480 | 0.0480 |
| ③ | T2 | 0.10 | 0.094 | 0.090 | 0.090 | 0.090 | 0.090 |
 CH3CH2OH+CH3COOH。
CH3CH2OH+CH3COOH。查看答案和解析>>
科目:高中化學 來源: 題型:填空題
(12分).
在1.0 L密閉容器中放入0.10molA(g),在一定溫度進行如下反應:
A(g) B(g)+C(g) △H=+85.1kJ·mol-1(吸熱反應)
B(g)+C(g) △H=+85.1kJ·mol-1(吸熱反應)
反應時間(t)與容器內氣體總壓強(p)的數據見下表:
| 時間t/h | 0 | 1 | 2 | 4 | 8 | 16 | 20 | 25 | 30 |
| 總壓強p/100kPa | 4.91 | 5.58 | 6.32 | 7.31 | 8.54 | 9.50 | 9.52 | 9.53 | 9.53 |
| 反應時間t/h | 0 | 4 | 8 | 16 |
| C(A)/(mol·L-1) | 0.10 | a | 0.026 | 0.0065 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
(15分)太陽能電池是利用光電效應實現能量變化的一種新型裝置,目前多采用單晶硅和多晶硅作為基礎材料。高純度的晶體硅可通過以下反應獲得:
反應①(合成爐):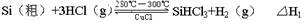
反應②(還原爐):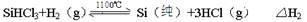
有關物質的沸點如下表所示:
| 物質 | BCl3 | PCl3 | SiCl4 | AsCl3 | AlCl3 | SiHCl3 |
| 沸點 | 12.1 | 73.5 | 57.0 | 129.4 | 180(升華) | 31.2 |
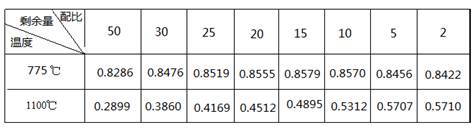
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
(15分)“低碳循環”已引起各國家的高度重視,而如何降低大氣中CO2的含量和有效地開發利用CO2正成為化學家研究的主要課題。
(l)用電弧法合成的儲氫納米碳管常伴有大量的碳納米顆粒(雜質),這種顆粒可用如下氧化法提純,請完成該反應的化學方程式:
(2)將不同量的CO(g)和H2O(g)分別通入到體積為2L的恒容密閉容器中,進行反應 ,得到如下兩組數據:
,得到如下兩組數據:
①實驗2條件下平衡常數K= __________。
②實驗3,若900℃時,在此容器中加入CO、H2O、CO2、H2均為1mol,則此時 ____________
____________ (填“<”,“>”,“=”)。
(填“<”,“>”,“=”)。
③由兩組實驗結果,可判斷該反應的正反應△H_____________0(填“<”,‘‘>”,“=”)。
(3)己知在常溫常壓下:
寫出甲醇不完全燃燒生成一氧化碳和液態水的熱化學方程式:________________________
①已知該反應的△H>0,簡述該設想能否實現的依據:________。
②目前,在汽車尾氣系統中裝置催化轉化器可減少CO和NO的污染,其化學反應方程式為__________。
(5)CO2在自然界循環時可與CaCO3反應,CaCO3是一種難溶物質,其Ksp=2.8× 10 。CaCl2溶液與Na2CO3溶液混合可形成CaCO3沉淀,現將等體積的CaCl2溶液與Na2CO3溶液混合,若Na2CO3溶液的濃度為1×10
。CaCl2溶液與Na2CO3溶液混合可形成CaCO3沉淀,現將等體積的CaCl2溶液與Na2CO3溶液混合,若Na2CO3溶液的濃度為1×10 mol/L,則生成沉淀所需CaCl2溶液的最小濃度為__________mol/L。
mol/L,則生成沉淀所需CaCl2溶液的最小濃度為__________mol/L。
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
某學生為了探究Zn與鹽酸反應過程中的速率變化,在100mL稀鹽酸中加入足量的Zn粉,用排水集氣法收集反應放出的H2,實驗記錄如下(累計值):
| 時間(min) | 1 | 2 | 3 | 4 | 5 |
| 氫氣體積(mL)(標況下) | 50 | 120 | 232 | 290 | 310 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com