
【題目】下列有關說法不正確的是( )
A. 常溫下,鹽酸和醋酸溶液,c(Cl-)=c(CH3COO-),做導電性實驗,醋酸的燈泡更亮
B. amolFeS與bmolFeO投入到VLcmol/L的稀硝酸溶液中充分反應,所得溶液成分看作Fe(NO3)3、H2SO4的混合液,則反應中未被還原的硝酸可能為(3a+3b)mol
C. AgI懸濁液中加入少量KI粉末,AgI(s)![]() Ag+(aq)+I-(aq)左移,溶液中離子總濃度增大
Ag+(aq)+I-(aq)左移,溶液中離子總濃度增大
D. 由酸性溶液中MnO4-可以氧化Cl-,可知酸性溶液MnO4-也可以氧化Br-
【答案】A
【解析】A.溶液的導電性與溶液中的離子濃度和離子所帶的電荷有關,常溫下,鹽酸和醋酸溶液中c(Cl-)=c(CH3COO-),則二者溶液中的c(H+)也相等,因此做導電性實驗時,鹽酸和醋酸溶液的燈泡亮度一樣,故A錯誤;B. 若硝酸恰好反應時,amolFeS與bmolFeO被氧化生成Fe(NO3)3,根據鐵原子守恒找出鐵原子和硝酸的關系式:amolFeS+bmolFeO→(a+b) molFe→(a+b) molFe(NO3)3→3(a+b) molHNO3,所以未被還原的硝酸的物質的量為(3a+3b) mol,故B正確;C. AgI(s)Ag+(aq)+I(aq),在AgI懸濁液中加入少量KI粉末,平衡向左移動,因溶液中加入了K+離子,則離子的總濃度增大,故C正確;D. 因Br-還原性大于Cl-,由酸性溶液中MnO4-可以氧化Cl-,則酸性溶液中MnO4-也可以氧化Br-,故D正確;答案選A。


 新思維小冠軍100分作業本系列答案
新思維小冠軍100分作業本系列答案 名師指導一卷通系列答案
名師指導一卷通系列答案科目:高中化學 來源: 題型:
【題目】可逆反應:2A(s)![]() B(g)+C(g)在體積固定的密閉容器中,起始時加入一定量的A,判斷反應達到平衡狀態的標志是: ①單位時間內生成2molA的同時生成1molB ②v(B):v(C)=1:1 ③密閉容器中混合氣體的平均摩爾質量不變 ④混合氣體的密度不再改變 ⑤B的體積分數不再改變 ⑥混合氣體的壓強不再改變的狀態
B(g)+C(g)在體積固定的密閉容器中,起始時加入一定量的A,判斷反應達到平衡狀態的標志是: ①單位時間內生成2molA的同時生成1molB ②v(B):v(C)=1:1 ③密閉容器中混合氣體的平均摩爾質量不變 ④混合氣體的密度不再改變 ⑤B的體積分數不再改變 ⑥混合氣體的壓強不再改變的狀態
A. ①③④⑤⑥ B. ①③④⑥ C. ①④⑥ D. 全部
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】甲、乙、丙、丁分別是Al2(SO4)3、FeSO4、NaOH、BaCl2四種物質中的一種,若將丁溶液滴入乙溶液中,發現有白色沉淀生成,繼續滴加則沉淀消失,丁溶液滴入甲溶液時,無明顯現象發生,據此可推斷丙物質是( )
A.Al2(SO4)3
B.NaOH
C.BaCl2
D.FeSO4
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】工業上常用煤和水作原料經過多步反應制得氫氣,其中一步反應的原理為CO(g)+H2O(g)![]() CO2(g)+H2(g),下列選項的條件中可判斷該反應達到平衡狀態的是( )
CO2(g)+H2(g),下列選項的條件中可判斷該反應達到平衡狀態的是( )
A. 單位時間內消耗2 mol的CO同時生成2 mol的CO2
B. 兩個H—O鍵斷裂的同時有一個H—H鍵斷裂
C. 反應容器內的壓強不再發生變化
D. 混合氣體的相對分子質量不發生變化
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列各組物質所屬類型全部正確的是
A. 堿性氧化物:Na2O Na2O2 A12O3
B. 酸性氧化物:CO Si02 SO2
C. 鹽:NH4N03 KA1(SO4)2 KHSO4
D. 堿:燒堿 純堿 堿石灰
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】回答下列問題:
(1) 某濃度的氨水中存在平衡:NH3·H2O ![]() NH4+ + OH-,如想增大NH4+的濃度而不增大OH-的濃度,可采取的措施是___________填字母)。
NH4+ + OH-,如想增大NH4+的濃度而不增大OH-的濃度,可采取的措施是___________填字母)。
a.適當升高溫度 b.加入NH4Cl固體
c.通入NH3 d.加入少量濃鹽酸
(2) 常溫下,有pH相同、體積相同的醋酸和鹽酸兩種溶液,采取以下措施:
①加適量醋酸鈉晶體后,兩溶液中的c(H+)變化情況是:
醋酸溶液中c(H+) _____________________(填“增大”、“減小”或“不變”),鹽酸溶液中c(H+) __________________(填“增大”、“減小”或“不變”)
②加水稀釋10倍后:醋酸溶液中的c(H+)________鹽酸溶液中的c(H+)(填“>”、“=”或“<”)。
③加等濃度的NaOH溶液至恰好中和,所消耗的NaOH溶液體積相比較:醋酸_____________鹽酸(填“>”、“=”或“<”)。
④使溫度都升高20 ℃后,兩溶液中c(H+)比較:醋酸____________鹽酸(填“>”、“=”或“<”)。
⑤ 分別與足量的鋅粉發生反應,下列關于氫氣體積(V)隨時間(t)變化的示意圖正確的是_________________(填字母,①代表鹽酸,②代表醋酸溶液)。

(3) 將0.1 mol·L-1的CH3COOH加水稀釋,有關稀釋后醋酸溶液的說法中,正確的是_________________ (填字母)。
a.電離程度增大 b.溶液中離子總數增多
c.溶液導電性增強 d.溶液中醋酸分子增多
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在一定條件下,反應N2+3H22NH3 , 在2L密閉容器中進行,5min內氨的質量增加了1.7g,則反應速率為( )
A.v(H2)=0.03 mol/(Lmin)
B.v(N2)=0.02 mol/(Lmin)
C.v(NH3)=0.17 mol/(Lmin)
D.v(NH3)=0.01 mol/(Lmin)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】日常生活中常用鋁制炊具,它質輕且堅固耐用,其中的原因是( )
A.鋁很不活潑,不易與其他物質反應
B.鋁雖然很活潑,但是只有在高溫下才能與其他物質反應
C.鋁制品表面有一層致密的氧化物薄膜,起保護作用
D.鋁制品表面鍍有一層銅,可以保護鋁制品
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】氧化還原反應及其應用在化學中占有重要地位。回答下列各題。
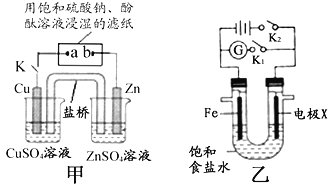
(1)寫出鋁與氫氧化鈉溶液反應的離子方程式____________________;若將鎂條、鋁條和靈敏電流計用導線相連,使鎂條、鋁條浸入氫氧化鈉溶液中,電流計指針發生偏轉時,負極材料為________。
(2)當閉合K時,甲裝置中Zn極的電極反應式為____;電子流動的方向為______;若鹽橋中填充KCl瓊脂,K+離子移動的方向為______;a極的電極反式為________;一段時間后,b極附近的現象為____________________。
(3)裝置乙中。
①斷開K2,接通K1。當X為石墨電極,Fe極的電極反應式為_________;當X為鋅電極,Fe極的電極反應式為_____________。
②斷開K1,接通K2。若X為石墨電極,X極的電極名稱為_____;裝置反應的離子方程式為_______________。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com