
【題目】下列說法正確的是
A.乙烯、苯均能與H2發生加成反應,說明兩者均含碳碳雙鍵
B.相同質量的烴完全燃燒,耗氧量最大的是CH4
C.相同質量的乙炔、苯分別在足量氧氣中燃燒,苯比乙炔消耗的氧氣質量多
D.乙烯、氯乙烯、聚氯乙烯均能使溴水褪色
 新活力總動員暑系列答案
新活力總動員暑系列答案 龍人圖書快樂假期暑假作業鄭州大學出版社系列答案
龍人圖書快樂假期暑假作業鄭州大學出版社系列答案科目:高中化學 來源: 題型:
【題目】某研究性學習小組利用硝酸和廢銅屑(含Cu和CuO)作為原料制備硝酸銅,設計的流程如下:
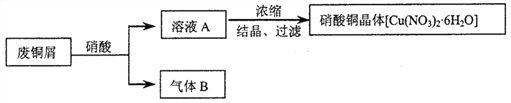
(1)某次實驗使用了廢銅屑共24g,用一定濃度的硝酸100mL完全溶解這些廢銅屑時,共收集到標準狀況下B氣體6.72L(其中NO2和NO的體積比為2∶1)。請通過計算回答下列問題:
①廢銅屑中銅和氧化銅的物質的量之比_____________。
②若測得溶液A中H+的濃度為1mol·L-1,則原硝酸的物質的量濃度為________________。(假設反應前后溶液的體積不變)
(2)上述制備方案中產生的氣體B,既造成原料的浪費,也污染了環境。請你設計方案解決上述問題___________________________________________________________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】25℃時,向20mL 0.1mol/L的氫氟酸溶液中逐滴加入0.1mol/L NaOH溶液,滴加過程中混合溶液的pH變化曲線如圖所示,回答下列問題: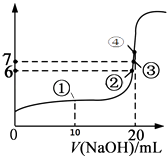
(1)若0.1mol/L的氫氟酸溶液中有0.1%的HF發生電離,則溶液的pH=;
(2)滴加NaOH溶液至恰好反應的過程中,水的電離程度(填寫“逐漸增大”、“不變”、“逐漸減小”);
(3)①點時,NaOH加入了10mL,此時溶液中各種微粒(不包括水)的濃度由大到小的順序是;
(4)③點時pH=7,此時溶液中c(F﹣)c(Na+)(填寫>、<或=);
(5)④點時,NaOH加入了20mL,此時溶液中有兩種微粒濃度之和等于0.05mol/L,這兩種微粒是和;
(6)若以NaOH溶液為標準液,通過滴定的方法測定另一未知濃度的HF溶液的濃度,推測最好使用的指示劑為(常見指示劑的變色范圍是:甲基橙3.1~4.4,酚酞8~10).
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】關于容量瓶的使用,下列操作正確的是( )
A.使用前要先檢查容量瓶是否漏液
B.用蒸餾水洗滌后必須要將容量瓶烘干
C.為了方便快捷,可以直接在容量瓶內進行固體溶解
D.定容結束后,為了使溶液均勻,手握瓶頸,左右振蕩
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】實驗室用NaOH固體和蒸餾水準確配制一定物質的量濃度的NaOH溶液.以下儀器中,不需要用到的是( )
A.燒杯
B.玻璃棒
C.容量瓶
D.蒸餾燒瓶
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某含砷(As )的有毒工業廢水經如下圖流程轉化為粗Aa2O3。已知:亞砷酸鈣微溶于水,砷酸鈣難溶于水。
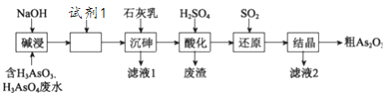
(1)加入試劑1的目的是:_________________________。
(2)“沉砷”是將砷元素轉化為Ca5(AsO4)3OH 沉淀,發生的主要反應有:
A.Ca(OH)2(s) ![]() Ca2+(aq) + 2OH-(aq) ΔH <0
Ca2+(aq) + 2OH-(aq) ΔH <0
B.5Ca2+ + OH-+ 3AsO43-![]() Ca5(AsO4)3OH ΔH >0
Ca5(AsO4)3OH ΔH >0
研究表明:“沉砷”的最佳溫度是85℃, 用化學平衡原理解釋溫度高于85℃后,隨溫度升高沉淀率下降的原因是________。
(3)“還原”過程中H3AsO4轉化為H3AsO3,反應的化學方程式是________。
(4)通過對H3AsO3溶液進行_____(填操作名稱),再過濾可制得粗As2O3。As2O3在不同溫度和不同濃度硫酸中的溶解度(S)曲線如下圖所示。為控制濾液2 中As2O3的濃度不高于6×10-5 mol·L-1 ,則“結晶”過程應控制的條件是______________________(例舉一例回答)
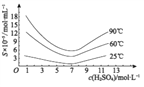
(5)從綠色化學和綜合利用的角度考慮,對濾液2 處理方法是:________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】氮化硅(Si3N4)是一種新型陶瓷材料,它可由石英與焦炭在高溫的氮氣流中,通過以下反應制得:
SiO2(s)+ C(s)+ N2(g)![]() Si3N4(s)+ CO(g)
Si3N4(s)+ CO(g)
(1)配平反應中各物質的化學計量數______,已知生成1 mol氮化硅(Si3N4)放出1 591.2 kJ的熱量,該反應每轉移1 mol e-,放出______kJ的熱量。
(2)該反應的平衡常數表達式為K=____。升高溫度,其平衡常數______(選填“增大”“減小”或“不變”)。
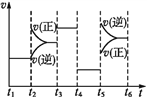
(3)該化學反應速率與反應時間的關系如上圖所示,t2時引起v(正)突變、v(逆)漸變的原因是_________,t3引起變化的因素為_________,t5時引起v(逆)大變化、v(正)小變化的原因是_________。
(4)利用右圖裝置,可以模擬鐵的電化學防護。
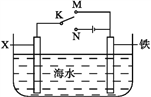
若X為碳棒,為減緩鐵的腐蝕,開關K應置于___處。若X為鋅,開關K置于M處,該電化學防護法稱為____________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某微粒用 AZQn+表示,下列關于該微粒的敘述正確的是( )
A.所含質子數=A-nB.所含中子數=A-Z
C.所含電子數=Z+nD.質量數=Z+A
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com