
 Si3N4(s)+12HCl(g),在溫度T0下的2 L密閉容器中,加入0.30 mol SiC14, 0.20 mol N2. 0.36 mol H2進行上述反應,2min后達到平衡,測得固體的質(zhì)量增加了2.80 g
Si3N4(s)+12HCl(g),在溫度T0下的2 L密閉容器中,加入0.30 mol SiC14, 0.20 mol N2. 0.36 mol H2進行上述反應,2min后達到平衡,測得固體的質(zhì)量增加了2.80 g
| A.該反應在任何溫度下可自發(fā)進行 |
| B.若混合氣體的總質(zhì)量不變,表明上述反應己達到平衡狀態(tài) |
| C.其他條件不變,增大Si3N4的物質(zhì)的量,平衡向左移動 |
| D.按3:2:6的物質(zhì)的量比增加反應物,SiC14(g)的轉(zhuǎn)化率降低 |

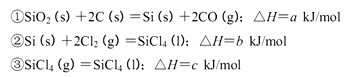


 千里馬走向假期期末仿真試卷寒假系列答案
千里馬走向假期期末仿真試卷寒假系列答案科目:高中化學 來源:不詳 題型:單選題
| A.若反應X+Y=M+N是放熱反應,該反應一定不用加熱 |
| B.需要加熱才能發(fā)生的反應一定是吸熱反應 |
| C.原電池正極和負極的材料必須是兩種金屬 |
| D.銅鋅原電池工作時,若有13g鋅被溶解,外電路中就有0.4mol電子通過 |
查看答案和解析>>
科目:高中化學 來源:不詳 題型:填空題
查看答案和解析>>
科目:高中化學 來源:不詳 題型:填空題
 Cl2(g)+CO(g) △H=+108kJ·mol-1。反應體系達到平衡后,各物質(zhì)的濃度在不同條件下的變化狀況如下同所示(第10min到14min的COCl2濃度變化曲線未示出):
Cl2(g)+CO(g) △H=+108kJ·mol-1。反應體系達到平衡后,各物質(zhì)的濃度在不同條件下的變化狀況如下同所示(第10min到14min的COCl2濃度變化曲線未示出):
查看答案和解析>>
科目:高中化學 來源:不詳 題型:單選題
| A.ΔH1>ΔH3>ΔH2 | B.ΔH1<ΔH2<ΔH3 |
| C.ΔH1=ΔH2=ΔH3 | D.ΔH1<ΔH3<ΔH2 |
查看答案和解析>>
科目:高中化學 來源:不詳 題型:填空題
 FeO(s)+CO(g) ΔH=akJ·mol-1,平衡常數(shù)為K;
FeO(s)+CO(g) ΔH=akJ·mol-1,平衡常數(shù)為K; CO2(g) ΔH=bkJ·mol-1;
CO2(g) ΔH=bkJ·mol-1; 2Fe(s)+3CO2(g) ΔH=ckJ·mol-1。測得在不同溫度下,K值如下:
2Fe(s)+3CO2(g) ΔH=ckJ·mol-1。測得在不同溫度下,K值如下:| 溫度/℃ | 500 | 700 | 900 |
| K | 1.00 | 1.47 | 2.40 |
 2FeO(s)的ΔH= 。
2FeO(s)的ΔH= 。查看答案和解析>>
科目:高中化學 來源:不詳 題型:填空題
 HOI(aq) △H2
HOI(aq) △H2 I2(aq) + H2O(l) △H3
I2(aq) + H2O(l) △H3 I3-(aq),其平衡常數(shù)表達式為_______.
I3-(aq),其平衡常數(shù)表達式為_______.


| A.c(H+)減小 | B.c(I-)減小 | C.I2(g)不斷生成 | D.c(Fe3+)增加 |
查看答案和解析>>
科目:高中化學 來源:不詳 題型:填空題
查看答案和解析>>
科目:高中化學 來源:不詳 題型:填空題
查看答案和解析>>
國際學校優(yōu)選 - 練習冊列表 - 試題列表
湖北省互聯(lián)網(wǎng)違法和不良信息舉報平臺 | 網(wǎng)上有害信息舉報專區(qū) | 電信詐騙舉報專區(qū) | 涉歷史虛無主義有害信息舉報專區(qū) | 涉企侵權(quán)舉報專區(qū)
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com