
【題目】冬季是霧霾天氣高發的季節,其中汽車尾氣和燃煤尾氣是造成霧霾的原因之一。
(1)使用甲醇汽油可以減少汽車尾氣對環境的污染。工業上在 200℃和 10MPa 的條件下可用甲烷和氧氣通過銅制管道反應制得甲醇,已知一定條件下,CH4 和 CH3OH 的燃燒熱分別 784kJ/mol 和 628kJ/mol 則 2CH4(g)+O2(g)![]() 2CH3OH(g) △H=_____。
2CH3OH(g) △H=_____。
(2)二甲醚也是清潔能源。用合成氣在催化劑存在下制備二甲醚的反應原理為:2CO(g)+4H2(g) CH3OCH3(g) +H2O(g) △H<0。某溫度下,,將 2.0molCO(g)和 6.0molH2(g)充入容積為 2L 的密閉容器中,反應到達平衡時, 改變壓強和溫度,平衡體系中 CH3OCH3(g)的物質的量分數變化情況如圖所示,關于溫度和壓強的關系判斷正確的是_____。
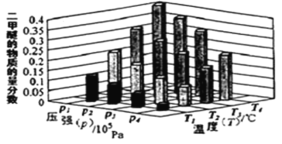
A.p3>p2,T3>T2
B.p1>p3,T1>T3
C.p1>p4,T2>T3
D.p2>p4,T4>T2
(3)汽車尾氣凈化的主要原理為:2NO(g)+2CO(g)![]() 2CO2(g) +N2(g);
2CO2(g) +N2(g);
①200K、pPa時,在一個容積為 2L的恒溫密閉容器中充入 1.5molNO 和 2.0molCO,開始反應至 2min 時測得 CO 轉化率為 30%,則用N2表示的平均反應速率為v(N2)=_________;反應達到平衡狀態時,測得二氧化碳為 0.8mol,則平衡時的壓強為起始壓強的_________倍(保留兩位小數)。
②該反應在低溫下能自發進行,該反應的ΔH_____0(填“>”、“<”)
(4)一定溫度下,將NO2與SO2以體積比 1:2 置于密閉容器中發生反應NO2(g)+SO2(g) SO3(g)+NO(g),達到平衡時SO3的體積分數為 25%。該反應的平衡常數K= ______。
(5)利用原電池反應可實現NO2 的無害化,總反應為6NO2+ 8NH3=7N2+12H2O,電解質溶液為堿性。工作一段時間后,該電池正極區附近溶液 pH ____(填“變大”、“變小”或“不變”),負極電極反應式為 ____。
【答案】312kJ/mol BC 0.075mol/(L·min) 0.89 < 1.8 變大 2NH3-6e-+6OH-=N2+6H2O
【解析】
(1)根據CH4和CH3OH的燃燒熱書寫二者熱化學方程式,結合蓋斯定律進行計算;
(2)根據溫度、壓強等外界條件對平衡移動的影響及圖中數據變化進行分析判斷;
(3)①根據CO轉化率計算消耗CO的物質的量,根據v =![]() 計算v(CO),再根據速率之比等于化學計量數之比計算v(N2);恒溫恒容時,壓強之比等于物質的量之比;
計算v(CO),再根據速率之比等于化學計量數之比計算v(N2);恒溫恒容時,壓強之比等于物質的量之比;
②由△H-T△S<0及反應中熵的變化來判斷;
(4)相同條件下體積之比等于物質的量之比,列三段式計算;
(5)正極上是二氧化氮得到電子發生還原反應,負極是氨氣失電子發生氧化反應,結合電極反應分析判斷。
(1)CH4和CH3OH的燃燒熱分別是784kJ/mol和628kJ/mol則①CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=-784kJ/mol,②CH3OH(g)+![]() O2(g)=CO2(g)+2H2O(l)△H=-628kJ/mol,結合蓋斯定律(①-②)2得到熱化學方程式2CH4(g)+O2(g)=2CH3OH(g)△H=-312kJ/mol,答案為:-312kJ/mol;
O2(g)=CO2(g)+2H2O(l)△H=-628kJ/mol,結合蓋斯定律(①-②)2得到熱化學方程式2CH4(g)+O2(g)=2CH3OH(g)△H=-312kJ/mol,答案為:-312kJ/mol;
(2)由圖可知,溫度升高CO的轉化率降低,說明升溫平衡逆向移動,故正反應為放熱反應,則溫度越高二甲醚的質量分數越小,所以溫度:T1>T2>T3>T4;正反應為氣體體積減小的反應,增大壓強平衡正向移動,二甲醚的質量分數增大,故壓強:p1>p2>p3>p4,答案選:BC;
(3)①消耗CO物質的量為2.0mol30%=0.6mol,v(CO)= =0.15 mol/(Lmin),速率之比等于化學計量數之比,所以v(N2)=
=0.15 mol/(Lmin),速率之比等于化學計量數之比,所以v(N2)=![]() v(CO)=0.075 mol/(L·min);開始通入1.5molNO 和 2.0molCO,反應達到平衡狀態時,測得二氧化碳為 0.8mol,列三段式為:
v(CO)=0.075 mol/(L·min);開始通入1.5molNO 和 2.0molCO,反應達到平衡狀態時,測得二氧化碳為 0.8mol,列三段式為:

恒溫恒容時,氣體的壓強之比等于物質的量之比,所以平衡時的壓強為起始時壓強的![]() =0.89,答案為:0.075 mol/(L·min);0.89;
=0.89,答案為:0.075 mol/(L·min);0.89;
②正反應為氣體物質的量減小的反應,為熵減小的反應,即△S<0,而△H-T△S<0反應能自發進行,該反應在低溫下能自發進行,所以該反應的△H<0;
(4)相同條件下體積之比等于物質的量之比,設NO2與SO2的物質的量分別為1mol、2mol,容器體積為1L,則NO2與SO2的初始濃度分別為1mol/L、2mol/L,列三段式為:
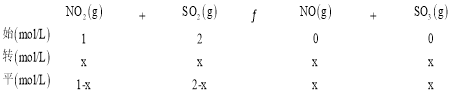
達到平衡時SO3的體積分數為25%,則![]() 100%=25%,解得x=0.75,該反應的平衡常數K=
100%=25%,解得x=0.75,該反應的平衡常數K=![]() =1.8;
=1.8;
(5)原電池工作時,負極發生氧化反應,正極發生還原反應,根據電池總反應6NO2+ 8NH3=7N2+12H2O,可知正極上是二氧化氮得到電子發生還原反應,電極反應式為:2NO2+8e-+4H2O=N2+8OH-,產生OH-,c(OH-)變大,pH變大;NH3在負極失去電子發生氧化反應,電極反應式為:2NH3-6e-+6OH-=N2+6H2O,答案為:變大;2NH3-6e-+6OH-=N2+6H2O。


 中考解讀考點精練系列答案
中考解讀考點精練系列答案科目:高中化學 來源: 題型:
【題目】如圖所示,將鐵棒和石墨棒插入盛有飽和NaCl溶液的U型管中![]() 下列分析正確的是
下列分析正確的是![]()
![]()

A. ![]() 閉合,鐵棒上發生的反應為
閉合,鐵棒上發生的反應為![]()
B. ![]() 閉合,石墨棒周圍溶液pH逐漸降低
閉合,石墨棒周圍溶液pH逐漸降低
C. ![]() 閉合,鐵棒不會被腐蝕,屬于外加電流的陰極保護法
閉合,鐵棒不會被腐蝕,屬于外加電流的陰極保護法
D. ![]() 閉合,電路中通過
閉合,電路中通過![]() 個電子時,兩極共產生
個電子時,兩極共產生![]() 氣體
氣體
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在下列反應中,水既不是氧化劑,也不是還原劑的是
A.2Na+2H2O=2NaOH+H2↑B.Cl2+H2O=HCl+HClO
C.2F2+2H2O=4HF+O2D.2H2O![]() 2H2↑+O2↑
2H2↑+O2↑
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】水芹烯是一種具有祛痰、抗菌、殺蟲作用的添加劑,由水芹烯合成聚合物 H 的路線如圖所示。
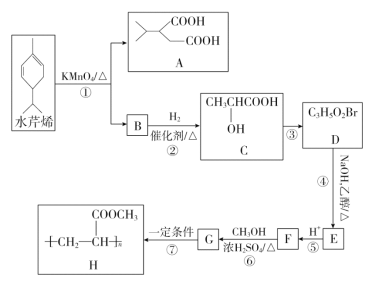
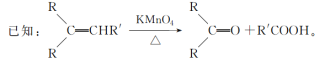
回答下列問題:
(1)B 的結構簡式為________,G 的結構簡式是________。
(2)反應③的反應試劑和反應條件分別是________,反應④的反應類型是________。
(3)反應⑥的化學方程式為________,反應⑥中濃 H2SO4 的作用是________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】分枝酸可用于生化研究。其結構簡式如圖。下列關于分枝酸的敘述正確的是

A. 分子中含有2種官能團
B. 可與乙醇、乙酸反應,且反應類型相同
C. 1mol分枝酸最多可與3molNaOH發生中和反應
D. 可使溴的四氯化碳溶液、酸性高錳酸鉀溶液褪色,且原理相同
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在下列物質的轉化關系中,A是一種固體物質,E是一種白色沉淀,據此填寫下列空白:
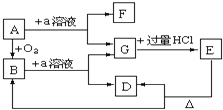
(1)B的化學式是________,B在固態時屬于________晶體,1mol 含有的共價鍵數目是______NA。
(2)E的化學式是_________。
(3)B和a溶液反應的離子方程式是_______________________________
(4)A和a溶液反應的化學方程式是___________________________________
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】市場上經常見到的標記為Li-ion的電池稱為“鋰離子電池”。它的負極材料是金屬鋰和碳的復合材料(碳作為金屬鋰的載體),電解質為一種能傳導Li+的高分子材料。這種電池的電池反應式為:Li+2Li0.35NiO2![]() 2Li0.85NiO2,下列說法不正確的是( )
2Li0.85NiO2,下列說法不正確的是( )
A.放電時,負極的電極反應式:Li-e-=Li+
B.充電時,Li0.85NiO2既發生氧化反應又發生還原反應
C.該電池不能用水溶液作為電解質溶液
D.放電過程中Li+向負極移動
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列生產、生活等實際應用,不能用勒夏特列原理解釋的是( )
A. 溴水中有下列平衡Br2+H2O ![]() HBr + HBrO,當加入AgNO3溶液后溶液顏色變淺
HBr + HBrO,當加入AgNO3溶液后溶液顏色變淺
B. 合成氨工業中使用鐵觸媒做催化劑
C. 用飽和食鹽水除去氯氣中氯化氫雜質
D. 對2HI(g)![]() H2(g)+I2(g),保持容器體積不變,通入氫氣可使平衡體系顏色變淺
H2(g)+I2(g),保持容器體積不變,通入氫氣可使平衡體系顏色變淺
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某化學研究性學習小組為了制取焦亞硫酸鈉(![]() ),并對其性質進行研究。特進行如下實驗:
),并對其性質進行研究。特進行如下實驗:
實驗一 制取焦亞硫酸鈉。
研究小組采用下圖裝置(實驗前已除盡裝置內的空氣)制取![]() 。裝置Ⅱ中有
。裝置Ⅱ中有![]() 晶體析出,發生的反應為:
晶體析出,發生的反應為:![]() 。
。
(1)裝置Ⅰ中通常采用70%~80%的濃硫酸與亞硫酸鈉固體反應制取![]() ,而不用98%的濃硫酸或極稀的稀硫酸,原因是________________________。
,而不用98%的濃硫酸或極稀的稀硫酸,原因是________________________。
(2)若要從裝置Ⅱ中獲得已析出的晶體,所采取的分離方法需用到的玻璃儀器有________。
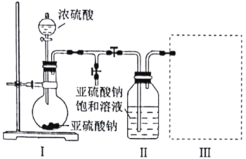
(3)裝置Ⅲ用于處理尾氣,請畫出用來處理尾氣并防止發生倒吸的實驗裝置,注明相應的試劑。
____________________________________________________________
(4)已知![]() 溶于水后,立即生成
溶于水后,立即生成![]() ,該反應的離子方程式為________________________。
,該反應的離子方程式為________________________。
(5)用![]() 試紙測得
試紙測得![]() 溶液呈酸性,其溶液呈酸性的原因是________________________。
溶液呈酸性,其溶液呈酸性的原因是________________________。
(6)取少量焦亞硫酸鈉晶體于試管中,其中滴加酸性![]() 溶液,劇烈反應,溶液紫紅色很快褪去,經測定溶液中產生
溶液,劇烈反應,溶液紫紅色很快褪去,經測定溶液中產生![]() ,該反應的離子方程式是________________________。
,該反應的離子方程式是________________________。
實驗三 焦亞硫酸鈉的含量測定。
測定產品中焦亞硫酸鈉的質量分數常用剩余碘量法。
已知:![]() ;
;![]() 。
。
①精確稱取干燥的產品![]() 放入碘量瓶(帶磨口塞的錐形瓶)中。
放入碘量瓶(帶磨口塞的錐形瓶)中。
②向碘量瓶中準確移取![]() ,
,![]() 的標準碘溶液(過量),振蕩,使其與產品中的焦亞硫酸鈉充分反應。
的標準碘溶液(過量),振蕩,使其與產品中的焦亞硫酸鈉充分反應。
③加入![]() 淀粉溶液,用標準
淀粉溶液,用標準![]() 溶液滴定至接近終點,重復操作3次,經計算得消耗標準液平均體積為
溶液滴定至接近終點,重復操作3次,經計算得消耗標準液平均體積為![]() 。
。
(7)上述實驗操作滴定終點的現象為________________________;根據上述實驗,計算產品中焦亞硫酸鈉的質量分數為________________________。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com