
氧化劑H2O2在反應時不產生污染物,被稱為綠色氧化劑,因而受到人們越來越多的關注。
Ⅰ.某實驗小組以H2O2分解為例,探究濃度、催化劑、溶液酸堿性對反應速率的影響。在常溫下按照下表所示的方案完成實驗。
| 實驗編號 | 反應物 | 催化劑 |
| ① | 10 mL 2%H2O2溶液 | 無 |
| ② | 10 mL 5%H2O2溶液 | 無 |
| ③ | 10 mL 5%H2O2溶液 | 1 mL 0.1 mol·L-1FeCl3溶液 |
| ④ | 10 mL 5%H2O2溶液+少量HCl溶液 | 1 mL 0.1 mol·L-1FeCl3溶液 |
| ⑤ | 10 mL 5%H2O2溶液+少量NaOH溶液 | 1 mL 0.1 mol·L-1FeCl3溶液 |



 導學教程高中新課標系列答案
導學教程高中新課標系列答案 小學課時特訓系列答案
小學課時特訓系列答案科目:高中化學 來源: 題型:問答題
聯氨(N2H4)及其衍生物是一類重要的火箭燃料。N2H4與N2O4反應能放出大量的熱。
(1)已知:2NO2(g) N2O4(g) △H=-57.20kJ·mol-1。一定溫度下,在密閉容器中此反應達到平衡。 其他條件不變時,下列措施不能使NO2轉化率提高的是
N2O4(g) △H=-57.20kJ·mol-1。一定溫度下,在密閉容器中此反應達到平衡。 其他條件不變時,下列措施不能使NO2轉化率提高的是
| A.減少NO2的濃度 | B.降低溫度 | C.增加NO2的濃度 | D.升高溫度 |
 N2O4(g)的平衡常數K= 。
N2O4(g)的平衡常數K= 。查看答案和解析>>
科目:高中化學 來源: 題型:計算題
工業制硫酸時,利用催化氧化反應將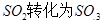 是一個關鍵的步驟。
是一個關鍵的步驟。
(1)某溫度下,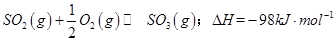 。開始時在100L的密閉容器中加入4.0molSO2(g)和10.0molO2,當反應達到平衡時共放出熱量196kJ,該溫度下平衡常數K=____________。
。開始時在100L的密閉容器中加入4.0molSO2(g)和10.0molO2,當反應達到平衡時共放出熱量196kJ,該溫度下平衡常數K=____________。
(2)一定條件下,向一帶活塞的密閉容器中充入2mol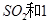 mol
mol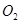 ,發生反應:
,發生反應: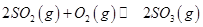 ,達平衡后改變下述條件,
,達平衡后改變下述條件,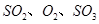 氣體平衡濃度都比原來增大的是____________(填字母)。
氣體平衡濃度都比原來增大的是____________(填字母)。
A.保持溫度和容器體積不變,充入2mol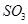 |
| B.保持溫度和容器體積不變,充入2molN2 |
C.保持溫度和容器內壓強不變,充入1mol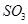 |
| D.移動活塞壓縮氣體 |
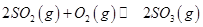 反應的圖像中,不正確的是_________。
反應的圖像中,不正確的是_________。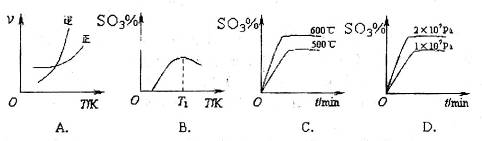
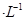 的硫酸溶液,當電解過程共轉移了0.1mol電子時,理論上消耗SO2的體積為(標準狀況)為_________,此溶液的pH="__________" (忽略溶液體積變化)。
的硫酸溶液,當電解過程共轉移了0.1mol電子時,理論上消耗SO2的體積為(標準狀況)為_________,此溶液的pH="__________" (忽略溶液體積變化)。 查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
以硫鐵礦(主要成分為FeS2)為原料制備氯化鐵晶體(FeCl3·6H2O)的工藝流程如下: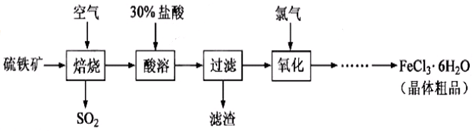
回答下列問題:
(1)在一定條件下,SO2轉化為SO3的反應為2SO2(g)+O2(g) 2SO3(g) ,該反應的平衡常數表達式為K= ;過量的SO2與NaOH溶液反應的化學方程式為
2SO3(g) ,該反應的平衡常數表達式為K= ;過量的SO2與NaOH溶液反應的化學方程式為
(2)酸溶及后續過程中均需保持鹽酸過量,其目的是 、 。
(3)通氯氣氧化后時,發生的主要反應的離子方程式為 ;該過程產生的尾氣可用堿溶液吸收,尾氣中污染空氣的氣體為 (寫化學式)。
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
(16分)某小組同學利用H2C2O4溶液和酸性KMnO4溶液反應來探究“條件對化學反應速率的影響”。實驗時,先分別量取兩種溶液,倒入大試管中迅速振蕩混合均勻,再加入硫酸,開始計時,通過測定混合溶液褪色所需時間來判斷反應的快慢(已知反應方程式為:5H2C2O4+2KMnO4+3H2SO4=2MnSO4+K2SO4+10CO2↑+8H2O)。該小組設計了如下方案。
| 編號 | H2C2O4溶液 | KMnO4溶液 | 硫酸溶液 | 溫度/℃ | ||
| | 濃度 (mol/L) | 體積 (mL) | 濃度 (mol/L) | 體積 (mL) | | |
| ① | 0.10 | 2.0 | 0.010 | 4.0 | 4mL 4mol/L | 25 |
| ② | 0.20 | 2.0 | 0.010 | 4.0 | 4mL 4mol/L | 25 |
| ③ | 0.20 | 2.0 | 0.010 | 4.0 | 4mL 4mol/L | 50 |
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
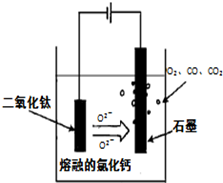
(14分)金屬鈦(Ti)性能優越,被稱為繼鐵、鋁之后的“第三金屬”。工業上以鈦鐵礦(主要成分FeTiO3,含FeO、Al2O3、SiO2等雜質)為主要原料冶煉金屬鈦,其生產的工藝流程圖如下:
已知:2H2SO4(濃)+ FeTiO3=TiOSO4 + FeSO4 + 2H2O
(1)步驟I中發生反應的離子方程式: 、 。
(2)已知:TiO2+易水解,只能存在于強酸性溶液中。
25 ℃時,難溶電解質溶解度與pH關系如圖,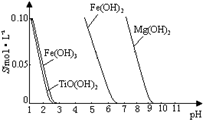
TiO(OH)2溶度積Ksp=1×10-29
①步驟Ⅲ加入鐵屑原因 是 。
② TiO2+水解的離子方程式為 。
向溶液II中加入Na2CO3粉末的作用是 。
當溶液pH= 時,TiO(OH)2已沉淀完全。
(3)TiCl4→Ti反應后得到Mg、MgCl2、Ti的混合物,可采用真空蒸餾的方法分離得到Ti,依據下表信息,需加熱的溫度略高于 ℃即可。
| | TiCl4 | Mg | MgCl2 | Ti |
| 熔點/℃ | -25.0 | 648.8 | 714 | 1667 |
| 沸點/℃ | 136.4 | 1090 | 1412 | 3287 |
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
某酸性工業廢水中含有K2Cr2O7。光照下,草酸(H2C2O4)能將其中的Cr2O72-轉化為Cr3+。某課題組研究發現,少量鐵明礬[Al2Fe(SO4)4 ·4H2O]即可對該反應起催化作用。為進一步研究有關因素對該反應速率的影響,探究如下
(1)在25°C下,控制光照強度、廢水樣品初始濃度和催化劑用量相同,調節不同的初始pH和一定濃度草酸溶液用量,作對比實驗,完成以下實驗設計表(表中不要留空格)。
| 實驗編號 | 初始 pH | 廢水樣品 體積/mL | 草酸溶液 體積/mL | 蒸餾水 體積/mL |
| ① | 4 | | 10 | 30 |
| ② | 5 | 60 | 10 | |
| ③ | | 60 | | 20 |
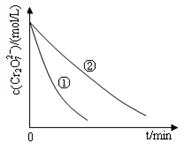
| 實驗方案(不要求寫具體操作過程) | 預期實驗結果和結論 |
| 取_______________________________代替實驗①中的鐵明礬,控制其他反應條件與實驗①相同,進行對比實驗 | 反應進行相同時間后 若溶液中的Cr2O72-濃度____________________________則假設一成立; 若溶液中的Cr2O72-濃度____________________________則假設一不成立; |
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
硫代硫酸鈉(Na2S2O3)俗稱大蘇打,照相業中用作定影劑。Na2S2O3易溶于水,在酸性溶液中與酸反應有單質硫和SO2生成。
(1)Na2S2O3溶液與稀硫酸混合反應可用于探究外界條件對反應速率的影響,完成有關的實驗設計表(已知各溶液體積均為5 mL):
| 實驗編號 | T/K | c(Na2S2O3)/ mol·L-1 | c(H2SO4)/ mol·L-1 | 實驗目的 |
| ① | 298 | 0.1 | 0.1 | 實驗①和②探究溫度對該反應速率的影響;實驗①、③和④探究反應物濃度對該反應速率的影響 |
| ② | 308 | | | |
| ③ | | 0.2 | | |
| ④ | | 0.1 | |
| 實驗步驟 | 預期現象和結論 |
| 步驟1:取少量固體于試管中,加蒸餾水溶解 | |
| 步驟2: | |
| 步驟3: | |
查看答案和解析>>
科目:高中化學 來源: 題型:單選題
把0.05molNaOH固體分別加入下列100mL溶液中,溶液的導電能力變化不大的是( )
| A.自來水 | B.0.5mol·L—1KOH溶液 |
| C.0.5mol·L—1醋酸 | D.0.5mol·L—1NH4Cl溶液 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com