
(共11分)工業(yè)廢水中常含有一定量的Cr2O72-和CrO42-,它們會(huì)對(duì)人類及生態(tài)系統(tǒng)產(chǎn)生很大的傷害,必須進(jìn)行處理。常用的處理方法有兩種。
方法l:還原沉淀法
該法的工藝流程為: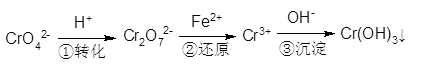
其中第①步存在平衡:2CrO42-(黃色)+2H+ Cr2O72-(橙色)+H2O
Cr2O72-(橙色)+H2O
(1)若平衡體系的pH=2,則溶液顯 色。
(2)能說明第①步反應(yīng)達(dá)平衡狀態(tài)的是 。
A.Cr2O2- 7和CrO2- 7的濃度相同 B.2v(Cr2O2- 7)=v(CrO2- 4) C.溶液的顏色不變
(3)第③步生成的Cr(OH)3在溶液中存在以下沉淀溶解平衡: Cr(OH)3(s)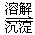 Cr3+(aq)+3OH-(aq)
Cr3+(aq)+3OH-(aq)
常溫下,Cr(OH)3的溶度積Ksp=c(Cr3+)?c3(OH-)=10-32,要使c(Cr3+)降至10-5mol/L,溶液的pH應(yīng)調(diào)至 。
方法2:電解法
該法用Fe做電極電解含Cr2O72-的酸性廢水,隨著電解進(jìn)行,在陰極附近溶液pH升高,產(chǎn)生Cr(OH)3沉淀。
(4)用Fe做電極的原因?yàn)?u> 。
(5)在陰極附近溶液pH升高的原因是(用電極反應(yīng)式解釋) 。溶液中同時(shí)生成的沉淀還有 。
(共11分)(1)橙 (1分);(2)C(2分); (3)5(2分);
(4)陽極反應(yīng)為Fe-2e-=Fe2+(2分);提供還原劑Fe2+(1分)
(5)2H+ +2e-=H2↑(2分);Fe(OH)3 (1分)
解析試題分析:(1)pH=2說明溶液顯酸性,平衡向正反應(yīng)方向移動(dòng),Cr2O72—的濃度會(huì)增大,所以溶液顯橙色。
(2)在一定條件下的可逆反應(yīng)里,當(dāng)正反應(yīng)速率和逆反應(yīng)速率相等,反應(yīng)物的濃度與生成物的濃度不再改變時(shí),該可逆反應(yīng)就到達(dá)化學(xué)平衡狀態(tài)。平衡時(shí)濃度不再發(fā)生變化,但物質(zhì)之間的濃度不一定相等或滿足某種關(guān)系,因此選項(xiàng)A不正確;在任何情況下Cr2O72—和CrO42—的反應(yīng)速率之比總是滿足1:2,因此選項(xiàng)B也不正確;顏色的深淺與濃度有關(guān)系,溶液顏色不再改變,這說明Cr2O72—和CrO42—的濃度不再發(fā)生改變,因此可以說明反應(yīng)已經(jīng)達(dá)到化學(xué)平衡狀態(tài),C正確,答案選C。
(3)由溶度積常數(shù)的表達(dá)式Ksp=c(Cr3+)·c3(OH—)=10-32可知,當(dāng)c(Cr3+)=10-5mol/L時(shí),c(OH—)=10-9mol/L,所以pH=5。
(4)Cr2O72—要生成Cr(OH)3沉淀,必需有還原劑,而鐵做電極時(shí),在陽極上可以失去電子產(chǎn)生Fe2+,陽極方程式為Fe-2e-=Fe2+。
(5)在電解池中陽離子在陰極得到電子,在溶液中由于H+得電子得能力強(qiáng)于Fe2+的,因此陰極是H+放電,方程式為2H++2e-=H2↑。隨著電解的進(jìn)行,溶液中的H+濃度逐漸降低,水的電離被促進(jìn),OH-濃度逐漸升高。由于Fe2+被Cr2O72—氧化生成Fe3+,當(dāng)溶液堿性達(dá)到一定程度時(shí)就會(huì)產(chǎn)生Fe(OH)3沉淀。
考點(diǎn):考查外界條件對(duì)平衡狀態(tài)的影響、平衡狀態(tài)的判斷;溶解平衡、電化學(xué)原理的應(yīng)用和計(jì)算等


 優(yōu)生樂園系列答案
優(yōu)生樂園系列答案 新編小學(xué)單元自測題系列答案
新編小學(xué)單元自測題系列答案
| 年級(jí) | 高中課程 | 年級(jí) | 初中課程 |
| 高一 | 高一免費(fèi)課程推薦! | 初一 | 初一免費(fèi)課程推薦! |
| 高二 | 高二免費(fèi)課程推薦! | 初二 | 初二免費(fèi)課程推薦! |
| 高三 | 高三免費(fèi)課程推薦! | 初三 | 初三免費(fèi)課程推薦! |
科目:高中化學(xué) 來源: 題型:填空題
用氮化硅(Si3N4)陶瓷代替金屬制造發(fā)動(dòng)機(jī)的耐熱部件, 能大幅度提高發(fā)動(dòng)機(jī)的熱效率。工業(yè)上用化學(xué)氣相沉積法制備氮化硅, 其反應(yīng)如下: 3SiCl4(g)+2N2(g)+6H2(g) Si3N4(s)+12HCl(g) ΔH <0
Si3N4(s)+12HCl(g) ΔH <0
完成下列填空:
(1)在一定溫度下進(jìn)行上述反應(yīng), 若反應(yīng)容器的容積為2 L, 3 min后達(dá)到平衡, 測得固體質(zhì)量增加了2. 80 g, 則轉(zhuǎn)移電子的物質(zhì)的量為 ,H2的平均反應(yīng)速率為 mol/(L·min); 該反應(yīng)的平衡常數(shù)表達(dá)式K= 。
(2)上述反應(yīng)達(dá)到平衡后, 下列說法正確的是 。
a. 其他條件不變, 壓強(qiáng)增大, 平衡常數(shù)K減小
b. 其他條件不變, 溫度升高, 平衡常數(shù)K減小
c. 其他條件不變, 增大Si3N4物質(zhì)的量,平衡向左移動(dòng)
d. 其他條件不變, 增大HCl物質(zhì)的量,平衡向左移動(dòng)
(3)一定條件下, 在密閉恒容的容器中, 能表示上述反應(yīng)達(dá)到化學(xué)平衡狀態(tài)的是 。
| A.3v逆(N2)=v正(H2) | B.v正(HCl)=4v正(SiCl4) |
| C.混合氣體密度保持不變 | D.c(N2)∶c(H2)∶c(HCl)=1∶3∶6 |
 , 保持其他條件不變, 降低溫度后達(dá)到新的平衡時(shí), H2和HCl的物質(zhì)的量之比
, 保持其他條件不變, 降低溫度后達(dá)到新的平衡時(shí), H2和HCl的物質(zhì)的量之比  (填“>”、“=”或“<”)。
(填“>”、“=”或“<”)。查看答案和解析>>
科目:高中化學(xué) 來源: 題型:填空題
300℃時(shí),將2mol A和2mol B兩種氣體混合于2L密閉容器中,發(fā)生如下反應(yīng):3A(g)+B(g) 2C(g)+2D(g) △H,2min末達(dá)到平衡,生成0.8mol D。
2C(g)+2D(g) △H,2min末達(dá)到平衡,生成0.8mol D。
(1)在2min末時(shí),A的平衡濃度為_____________,B的轉(zhuǎn)化率___________,0-2min內(nèi)D的平均反應(yīng)速率為_____________。
(2)該反應(yīng)的平衡常數(shù)表達(dá)式為:K=_____________。該溫度下的化學(xué)平衡常數(shù)數(shù)值為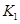 =____________。
=____________。
已知350℃時(shí)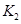 =l,則△H________0(填“>”或“<”)。
=l,則△H________0(填“>”或“<”)。
(3)在300℃時(shí),將該反應(yīng)容器壓縮體積為lL。則A的轉(zhuǎn)化率___________(填“增大”、“減小”或“不變”),原因是__________________。該條件下的平衡常數(shù)為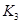 。 則K3________
。 則K3________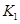 ,(填“<”或“>”或“=”)。原因是_______________________。
,(填“<”或“>”或“=”)。原因是_______________________。
(4)能判斷該反應(yīng)是否達(dá)到化學(xué)平衡狀態(tài)的依據(jù)是__________________(多選扣分)。
A.容器中壓強(qiáng)不變 B.混合氣體中c(A)不變
C.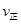 (A)=
(A)=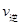 (C) D.混合氣體密度不變
(C) D.混合氣體密度不變
查看答案和解析>>
科目:高中化學(xué) 來源: 題型:填空題
鐵及其化合物在生產(chǎn)、生活中應(yīng)用廣泛。
(1)一定條件下,F(xiàn)e與CO2可發(fā)生反應(yīng):
2Fe(s)+3CO2(g) Fe2O3(s)+3CO(g)
Fe2O3(s)+3CO(g)
該反應(yīng)的平衡常數(shù)(K ) 隨溫度(T ) 升高而增大。
①該反應(yīng)的平衡常數(shù)K=______。(填表達(dá)式)
②下列措施中,能使平衡時(shí)c(CO)/c(CO2) 增大的是 (填標(biāo)號(hào))。
| A.升高溫度 | B.增大壓強(qiáng) |
| C.充入一定量CO | D.再加一些鐵粉 |
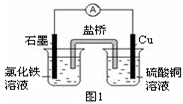
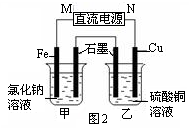
查看答案和解析>>
科目:高中化學(xué) 來源: 題型:填空題
(12分)向體積為2L的固定密閉容器中通入3molX氣體,在一定溫度下發(fā)生如下反應(yīng):
2X(g) Y(g)+3Z(g)
Y(g)+3Z(g)
(1)經(jīng)5min后反應(yīng)達(dá)到平衡,此時(shí)測得容器內(nèi)的壓強(qiáng)為起始時(shí)的1.2倍,則用Y的物質(zhì)的量濃度變化表示的速率為 。
(2)若上述反應(yīng)在甲、乙、丙、丁四個(gè)同樣的密閉容器中進(jìn)行,在同一段時(shí)間內(nèi)測得容器內(nèi)的反應(yīng)速率分別為:甲v(X)=3.5mol/(L?min);乙v(Y)=2mol/(L?min);丙v(Z)=4.5mol/(L?min);丁v(X)=0.075mol/(L?s)。若其它條件相同,溫度不同,則溫度由高到低的順序是(填序號(hào)) 。
(3)若向達(dá)到(1)的平衡體系中充入氬氣,則平衡向 (填"左"或"右"或"不")移動(dòng);若向
達(dá)到(1)的平衡體系中移走部分混合氣體,則平衡向 (填" 左 " 或 " 右 " 或 " 不")移動(dòng)。
(4)若在相同條件下向達(dá)到(1)所述的平衡體系中再充入0.5molX氣體,則平衡后X的轉(zhuǎn)化率⑷與⑴的
平衡中的X的轉(zhuǎn)化率相比較 。
| A.無法確定 | B.⑷一定大于⑴ | C.⑷一定等于⑴ | D.⑷一定小于⑴ |
查看答案和解析>>
科目:高中化學(xué) 來源: 題型:填空題
甲醇是重要的化工原料和清潔液體燃料。工業(yè)上可利用CO或CO2來生產(chǎn)甲醇。甲醇制
備的相關(guān)信息如下表: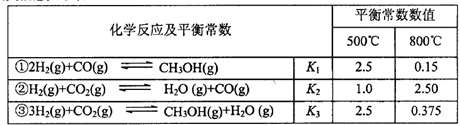
(1)反應(yīng)②是____反應(yīng)(選填“吸熱”“放熱”)。
(2)據(jù)上表信息推導(dǎo)出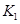 、
、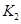 與
與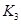 之間的關(guān)系,
之間的關(guān)系,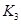 =______用
=______用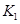 、
、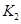 表示)。500℃時(shí)測得反應(yīng)③在某時(shí)刻,
表示)。500℃時(shí)測得反應(yīng)③在某時(shí)刻,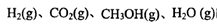 的濃度(mol/L)分別為0 8、0.1、0 3、0 15,此時(shí)
的濃度(mol/L)分別為0 8、0.1、0 3、0 15,此時(shí) (選填“>”“<”“=”)。
(選填“>”“<”“=”)。
(3)若某溫度下反應(yīng)①從開始到平衡CO和CH3OH的濃度變化如圖一所示,則用H2濃度變化表示此段時(shí)間內(nèi)該反應(yīng)的平均速.v(H2)= 若某溫度下反應(yīng)①中H2的平衡轉(zhuǎn)化率(a)與體系總壓強(qiáng)(P)的關(guān)系如圖二所示,則平衡狀態(tài)由A變到B時(shí),平衡常數(shù) (選填“>”“<”“=”)。
(選填“>”“<”“=”)。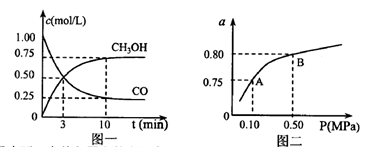
(4)一定溫度下,在體積固定的密閉容器中發(fā)生反應(yīng)②,可判斷該反應(yīng)已經(jīng)達(dá)到平衡的是____。(用相應(yīng)字母表示)
| A.容器中總壓強(qiáng)不變 |
| B.混臺(tái)氣體的平均摩爾質(zhì)量也始終保持不變, |
| C.混合氣體的密度不變 |
| D.CO2(g)或CO(g)的濃度不變 |
查看答案和解析>>
科目:高中化學(xué) 來源: 題型:填空題
在一固定容積為2L的密閉容器內(nèi)加入0.2mol的N2和0.6mol的H2,在一定條件下發(fā)生如下反應(yīng):N2(g)+3H2(g) 2NH3(g) △H<0 。反應(yīng)中NH3的物質(zhì)的量濃度的變化情況如下圖所示,請(qǐng)回答下列問題:
2NH3(g) △H<0 。反應(yīng)中NH3的物質(zhì)的量濃度的變化情況如下圖所示,請(qǐng)回答下列問題: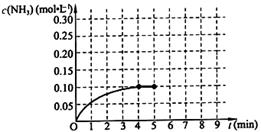
根據(jù)圖,計(jì)算從反應(yīng)開始到平衡時(shí),平均反應(yīng)速率v(NH3)= 。
⑵下列描述中能說明上述反應(yīng)已達(dá)平衡的是 。
| A.3v正(H2)=2v逆(NH3) |
| B.容器中氣體的平均相對(duì)分子量不隨時(shí)間而變化 |
| C.容器中氣體的密度不隨時(shí)間而變化 |
| D.容器中氣體的分子總數(shù)不隨時(shí)間而變化 |
查看答案和解析>>
科目:高中化學(xué) 來源: 題型:填空題
研究NO2、SO2、CO等大氣污染物的處理具有重要意義。NO2可用下列反應(yīng)來處理:
6 NO2(g)+8NH3(g)  7N2(g)+12H2O(g)+Q(Q>0)。
7N2(g)+12H2O(g)+Q(Q>0)。
完成下列填空:
(1)反應(yīng)的平衡常數(shù)大,處理NO2的效率高。增大該反應(yīng)平衡常數(shù)的措施有 。
(2)一定條件下上述反應(yīng)在某體積固定的密閉容器中進(jìn)行,能說明該反應(yīng)已經(jīng)達(dá)到平衡狀態(tài)的是 。
a.c(NO2):c(NH3) = 3:4 b.6v(NO2) = 7v(N2)
c.容器內(nèi)氣體總壓強(qiáng)不再變化 d.容器內(nèi)氣體密度不再變化
(3)若平衡時(shí)NO2和N2的濃度之比為m/n,保持其它條件不變,縮小反應(yīng)容器的體積后達(dá)到新的平衡,此時(shí)NO2和N2的濃度之比 m/n(填“>”、“=”或“<”)。
(4)某溫度下,在一個(gè)容積為2升的反應(yīng)容器內(nèi),上述反應(yīng)2分鐘后達(dá)到平衡,測得剛好有3mol電子發(fā)生轉(zhuǎn)移,則在2分鐘內(nèi)NH3的平均反應(yīng)速率為:
v(NH3) = 。
查看答案和解析>>
科目:高中化學(xué) 來源: 題型:填空題
已知2A(g)+B(g)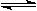 2C(g),向容積為1L的密閉容器中加入0.050 mol A和0.025mol B,在500℃時(shí)充分反應(yīng),達(dá)平衡后測得c(C)="0.040" mol·L-1,放出熱量Q1kJ。
2C(g),向容積為1L的密閉容器中加入0.050 mol A和0.025mol B,在500℃時(shí)充分反應(yīng),達(dá)平衡后測得c(C)="0.040" mol·L-1,放出熱量Q1kJ。
⑴能說明上述反應(yīng)已經(jīng)達(dá)到化學(xué)平衡狀態(tài)的是 (填寫序號(hào))
a.v(C)=2v(B) b.容器內(nèi)壓強(qiáng)保持不變
c.v逆(A)=2v正(B) d.容器內(nèi)氣體的密度保持不變
⑵若在相同的容器中只加入0.050 mol C,500℃時(shí)充分反應(yīng)達(dá)平衡后,吸收熱量Q2kJ,則Q1與Q2之間的關(guān)系式可表示為 (用含Q1、Q2的代數(shù)式表示);
⑶500℃時(shí),上述反應(yīng)的化學(xué)平衡常數(shù)K= ;
⑷已知:K(300℃)>K(350℃),該反應(yīng)是 (填“放”或“吸”)熱反應(yīng);若反應(yīng)溫度升高,A的轉(zhuǎn)化率 (填“增大”、“減小”或“不變”);
⑸某溫度下,A的平衡轉(zhuǎn)化率(a)與體系總壓強(qiáng)(P)的關(guān)系如圖所示,平衡狀態(tài)由a變到b時(shí),化學(xué)平衡常數(shù)K(A) K(B)(填“>”、“<”或“=”)。
查看答案和解析>>
國際學(xué)校優(yōu)選 - 練習(xí)冊(cè)列表 - 試題列表
湖北省互聯(lián)網(wǎng)違法和不良信息舉報(bào)平臺(tái) | 網(wǎng)上有害信息舉報(bào)專區(qū) | 電信詐騙舉報(bào)專區(qū) | 涉歷史虛無主義有害信息舉報(bào)專區(qū) | 涉企侵權(quán)舉報(bào)專區(qū)
違法和不良信息舉報(bào)電話:027-86699610 舉報(bào)郵箱:58377363@163.com