
下列四種鹽酸溶液,均能跟鋅片反應,其中最初反應速率最快的是
| A.10℃ 20mL 3mol/L的鹽酸溶液 | B.20℃ 30mL 2mol/L的鹽酸溶液 |
| C.20℃ 20mL 2mol/L的鹽酸溶液 | D.20℃ 10mL 4mol/L的鹽酸溶液 |
 世紀百通優練測系列答案
世紀百通優練測系列答案 百分學生作業本題練王系列答案
百分學生作業本題練王系列答案科目:高中化學 來源: 題型:單選題
為減小CO2對環境的影響,在倡導“低碳”的同時,還需加強對CO2創新利用的研究。T10C 時,將9molCO2和12molH2充入3L密閉容器中,發生反應CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH<0,容器中CH3OH的物質的量隨時間變化如曲線I所示,平衡時容器內壓強為P。改變某一條件重新進行上述反應,CH3OH的物質的量隨時間變化如曲線II所示。下列說法錯誤的是
CH3OH(g)+H2O(g) ΔH<0,容器中CH3OH的物質的量隨時間變化如曲線I所示,平衡時容器內壓強為P。改變某一條件重新進行上述反應,CH3OH的物質的量隨時間變化如曲線II所示。下列說法錯誤的是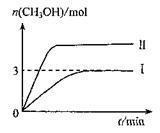
| A.曲線II對應的條件改變是增大壓強 |
| B.T2°C時,上述反應平衡常數為0.42,則T2> T1 |
| C.在T10C,若起始時向容器中充入5 mol CO2、5 mol H2、5 mol CH3OH(g)和5 mol H2O(g),則達平衡前v(正)>v(逆) |
D.在T10C,若起始時向容器由通入4,5 molCO2、6mol H2 ,平衡時容器內壓強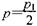 |
查看答案和解析>>
科目:高中化學 來源: 題型:單選題
關于下列四個說法正確的是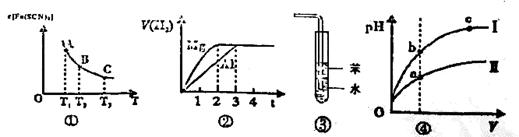
| A.已知圖①是體系Fe3++3SCN-=Fe(SCN)3中c[Fe(SCN)3]與溫度T的平衡圖像,則A點與B點相比,A點的Fe3+濃度大 |
| B.圖②表示鎂和鋁分別與等濃度、等體積的過量稀硫酸反應,產生氣體的體積V(H2) 與時間t的關系。則反應中鎂和鋁的反應速率之比為2 : 3 |
| C.圖③可用于吸收HCl氣體,并防倒吸 |
| D.圖④是某溫度下,相同體積,相同pH的鹽酸和醋酸溶液分別加水稀釋,pH隨溶液體積V變化的曲線。II為醋酸稀釋時pH的變化曲線 |
查看答案和解析>>
科目:高中化學 來源: 題型:單選題
在25℃時,密閉容器中X、Y、Z三種氣體的濃度變化情況如圖: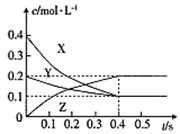
下列說法錯誤的是( )
A.反應可表示為3X+Y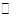 2Z 2Z |
| B.從反應開始到0.4s時,以Y表示的化學反應速率為:0.25mol·L-1·s-1 |
| C.增大壓強使平衡向生成Z的方向移動,平衡常數增大 |
| D.升高溫度,平衡常數可能增大也可能減小 |
查看答案和解析>>
科目:高中化學 來源: 題型:單選題
下列措施中,能減慢化學反應速率的是
| A.食物儲存在冰箱里 |
| B.將塊狀固體藥品研細后再反應 |
| C.用MnO2作H2O2分解反應的催化劑 |
| D.用30%H2SO4溶液代替5%H2SO4溶液與鋅粒反應 |
查看答案和解析>>
科目:高中化學 來源: 題型:單選題
工業制硫酸中的一步重要反應是SO2在400~500℃下的催化氧化:2SO2+O2 2SO3,這是一個放熱的可逆反應。如果反應在密閉容器中進行,下列有關說法中,錯誤的是
2SO3,這是一個放熱的可逆反應。如果反應在密閉容器中進行,下列有關說法中,錯誤的是
| A.使用催化劑是為了加快反應速率,提高生產效率 |
| B.在上述條件下,SO2不可能100%地轉化為SO3 |
| C.達到平衡時,改變反應條件可能在一定程度上改變該反應的化學平衡狀態 |
| D.達到平衡時,SO2的濃度與SO3的濃度一定相等 |
查看答案和解析>>
科目:高中化學 來源: 題型:單選題
將H2(g)和Br2(g)充入恒容密閉容器中,恒溫下發生反應H2(g)+Br2(g)  2HBr(g) (正反應放熱),平衡時Br2(g)的轉化率為a;若初始條件相同,絕熱下進行上述反應,平衡時Br2(g)的轉化率為b。 a與b的關系是
2HBr(g) (正反應放熱),平衡時Br2(g)的轉化率為a;若初始條件相同,絕熱下進行上述反應,平衡時Br2(g)的轉化率為b。 a與b的關系是
| A.a>b | B.a =b | C.a <b | D.無法確定 |
查看答案和解析>>
科目:高中化學 來源: 題型:單選題
在一個體積固定的密閉容器中,進行可逆反應A(s)+3B(g) 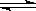 3C (g) 。下列敘述中表明該可逆反應一定達到平衡狀態的是
3C (g) 。下列敘述中表明該可逆反應一定達到平衡狀態的是
①C的生成速率與C的分解速率相等;②單位時間內生成amol A,同時生成3amol B;
③B的濃度不再變化; ④混合氣體總的物質的量不再發生變化;
⑤A、B、C的物質的量之比為1:3:3; ⑥混合氣體的密度不再變化;
A.①③⑥ B.①③④⑥ C.①②③ D.①③④⑤
查看答案和解析>>
科目:高中化學 來源: 題型:單選題
100mL 6 mol / L H2SO4跟過量鋅粉反應,在一定溫度下,為了減緩反應進行的速率,但又不影響生成氫氣的總量,可向反應物中加入適量的
| A.硫酸鉀溶液 | B.醋酸 | C.氯化鈉(固體) | D.鹽酸 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com