
【題目】物質A是生產各種塑料的重要單體,工業上采用物質B分解制備物質A的同時釋放出氫氣,其制備原理是:
B(g)A(g)+H2(g)△H=+125kJmol﹣1
(1)該反應的平衡常數表達式為K= . 隨著溫度的升高,K值(填“增大”、“減小”或“不變”).
(2)實際生產中常以高溫水蒸氣作為反應體系的稀釋劑(稀釋劑不參加反應).物質B的平衡轉化率與水蒸氣的用量、體系總壓強關系如圖.
①由圖可得出:
結論一:其他條件不變,水蒸氣的用量越大,平衡轉化率越;
結論二:
②加人稀釋劑能影響反應物B的平衡轉化率的原因是: .
(3)某些工藝中,在反應的中途加入O2和特定的催化劑,有利于提高B的平衡轉化率.試解釋其原因: .
【答案】
(1)![]() ,增大
,增大
(2)高,其他條件不變,體系總壓強越大,平衡轉化率越小,總壓強不變時,加入稀釋劑,同等程度的減少反應物及生成物濃度,相當于體系減壓,故平衡向氣體物質的量增大的方向移動,物質B的平衡轉化率增大(總壓強不變,加入稀釋劑,同等程度的減少反應物及生成物濃度,運算濃度熵小于K,故平衡正移)
(3)氧氣將反應生成的氫氣消耗掉,減小了氫氣的濃度;同時該反應放熱使體系溫度升高,平衡正反應方向移動
【解析】解:(1)已知B(g)A(g)+H2(g)△H=+125kJmol﹣1,則該反應的平衡常數為:K= ![]() ,已知溫度升高時轉化率增大,平衡正移,所以K增大;
,已知溫度升高時轉化率增大,平衡正移,所以K增大;
故答案為: ![]() ;增大;
;增大;
(2)①其他條件不變,水蒸氣的用量越大,平衡正移,平衡轉化率越大;根據圖象分析,壓強越大,轉化率越小,
故答案為:高;其他條件不變,體系總壓強越大,平衡轉化率越小;
②根據分壓對平衡移動的影響分析可知:總壓強不變時,加入稀釋劑,同等程度的減少反應物及生成物濃度,相當于體系減壓,故平衡向氣體物質的量增大的方向移動,物質B的平衡轉化率增大(總壓強不變,加入稀釋劑,同等程度的減少反應物及生成物濃度,運算濃度熵小于K,故平衡正移);
故答案為:總壓強不變時,加入稀釋劑,同等程度的減少反應物及生成物濃度,相當于體系減壓,故平衡向氣體物質的量增大的方向移動,物質B的平衡轉化率增大(總壓強不變,加入稀釋劑,同等程度的減少反應物及生成物濃度,運算濃度熵小于K,故平衡正移);
(3)O2與反應生成的氫氣反應,且反應放熱,所以平衡正移有利于提高C6H5C2H5的平衡轉化率,
故答案為:氧氣將反應生成的氫氣消耗掉,減小了氫氣的濃度;同時該反應放熱使體系溫度升高,平衡正反應方向移動.
(1)根據平衡常數的定義書寫K的表達式,該反應是一個吸熱反應,溫度升高轉化率增大,判斷K的變化;
(2)①根據圖象分析反應物濃度對平衡的影響;根據圖象分析壓強對平衡的影響;
②根據分壓對平衡移動的影響分析;
(3)O2與反應生成的氫氣反應,且反應放熱.


科目:高中化學 來源: 題型:
【題目】Na及其化合物是生活、生產實踐中的重要物質.請回答下列有關問題.
(1)鈉跟水劇烈反應,生成和 , 此實驗說明鈉的化學性質活潑.
(2)鈉有兩種氧化物,其中用于呼吸面具和潛水艇中作為氧氣來源的氧化物是 , 該物質中氧元素的化合價為 .
(3)固體碳酸鈉中含有碳酸氫鈉雜質,除去此雜質的簡單方法是 .
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】對大氣污染物NOx進行研究具有重要環保意義。
(1)已知汽車汽缸中生成NO的反應為:N2(g)+O2(g)![]() 2NO(g)-Q。若1.0 mol空氣含0.80 mol N2和0.20 mol O2,1300oC時在10.0 L密閉汽缸內經過5s反應達到平衡,測得NO為0.02mol/L。請回答下列問題:5s內該反應的平均速率ν(N2)=_____________。 汽車啟動后,汽缸溫度越高,單位時間內NO排放量越大,原因是:______________________________。
2NO(g)-Q。若1.0 mol空氣含0.80 mol N2和0.20 mol O2,1300oC時在10.0 L密閉汽缸內經過5s反應達到平衡,測得NO為0.02mol/L。請回答下列問題:5s內該反應的平均速率ν(N2)=_____________。 汽車啟動后,汽缸溫度越高,單位時間內NO排放量越大,原因是:______________________________。
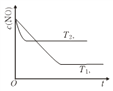
(2)右圖表示在其他條件不變時,反應2NO(g)+2CO(g)![]() 2CO2(g)+N2(g) 中,NO的濃度c(NO)在不同溫度(T)下隨時間(t)的變化曲線。該平衡的正向反應為_________反應 (填“吸熱”或“放熱”)。
2CO2(g)+N2(g) 中,NO的濃度c(NO)在不同溫度(T)下隨時間(t)的變化曲線。該平衡的正向反應為_________反應 (填“吸熱”或“放熱”)。
(3)為了減少汽車尾氣對環境的污染,可采取的措施________________________(任寫一個)。
另一方面,氮的許多化合物為我們人類生活帶來便利。
(4)氨水是一種很好的氮肥,常溫下測定0.1mol/L氨水溶液,其pH值小于13,其原因是_____(用電離方程式解釋);常見氮肥種類有______________(列舉兩個)。
(5)硝酸銨易溶于水,其水溶液呈 ________(填“酸性”、“堿性”、或“中性”),原因是____________ (用離子方程式表示)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某可逆反應達到平衡狀態時,下列說法不正確的是( )
A. 正反應和逆反應同時進行,兩者速率相等
B. 反應混合物的組成比例不會因時間而改變
C. 反應物和生成物同時存在,其濃度不再改變
D. 反應物和生成物的物質的量一定相等
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】根據問題進行計算:
(1)實驗測得16g甲醇[CH3OH(l)]在氧氣中充分燃燒生成二氧化碳氣體和液態水時釋放出363.25kJ的熱量,試寫出甲醇燃燒熱的熱化學方程式: .
(2)從化學鍵的角度分析,化學反應的過程就是反應物的化學鍵被破壞和生成物的化學鍵的形成過程.已知反應:N2(g)+3H2(g)2NH3(g)△H=a kJmol﹣1 . 有關鍵能數據如表:
化學鍵 | H﹣H | N﹣H | N≡N |
鍵能(kJmol﹣1) | 436 | 391 | 945 |
試根據表中所列鍵能數據估算a的數值 .
(3)依據蓋斯定律可以對某些難以通過實驗直接測定的化學反應的反應熱進行推算.已知:
C(s,石墨)+O2(g)═CO2(g)△H1=﹣393.5kJmol﹣1
2H2(g)+O2(g)═2H2O(l)△H2=﹣571.6kJmol﹣1
2C2H2(g)+5O2(g)═4CO2(g)+2H2O(l)△H3=﹣2599kJmol﹣1
根據蓋斯定律,計算298K時由C(s,石墨)和H2(g)生成1mol C2H2(g)反應的反應熱為:△H= .
(4)在微生物作用的條件下,NH4+經過兩步反應被氧化成NO3﹣ . 兩步反應的能量變化示
意圖如圖: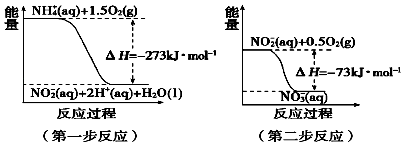
第一步反應是反應(填“放熱”或“吸熱”),原因是 .
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某溶液中可能含有H+、Na+、NH4+、Mg2+、Fe3+、Al3+、SO42-、CO32- 等離子。當向該溶液中加入一定物質的量濃度的NaOH溶液時,發現生成沉淀的物質的量隨NaOH溶液的體積變化的圖像如圖所示,下列說法正確的是
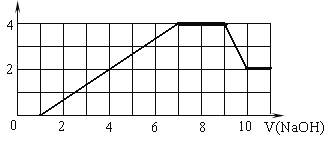
A. 原溶液中含有的陽離子是H+、NH4+、Mg2+、Al3+
B. 原溶液中一定含有SO42— 和Na+
C. 原溶液中含有的Fe3+和Al3+的物質的量之比為1∶1
D. 反應最后形成的溶液中含有的溶質為Na2SO4
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】①現有下列6種有機物A.苯B.乙烯C.乙烷D.乙醇E.乙酸F.油酸。
常溫下能與溴水反應的有(填編號)___________。
②下列各組物質:
A.金剛石與石墨; B.淀粉與纖維素; C.乙烯與聚乙烯; D.甲烷與戊烷;
E.![]() 與
與![]() F.H2O與D2O G.葡萄糖與果糖 H.蔗糖與麥芽糖
F.H2O與D2O G.葡萄糖與果糖 H.蔗糖與麥芽糖
I.甘氨酸與丙氨酸 J.乙醇與甘油
其中互為同分異構體的是___________(填編號)。
③A.玻璃鋼 B.明礬 C.隔熱陶瓷瓦 D.氯丁橡膠 E.在合成樹脂中加入碳纖維的材料 F.合成纖維
其中屬于復合材料的是___________(填編號)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列實驗過程中,溶液的pH增大的是
A. 向NaOH溶液中加水 B. 向NaCl溶液中滴加稀鹽酸
C. 向NaOH溶液中滴加稀鹽酸 D. 向稀鹽酸中滴加NaOH溶液
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com