
1.52 g銅鎂合金完全溶解于50 mL密度為1.40 g/mL、質量分數為63%的濃硝酸中,得到NO2和N2O4的混合氣體1120 mL(標準狀況),向反應后的溶液中加入1.0 mol/L NaOH溶液,當金屬離子全部沉淀時,得到2.54 g沉淀。下列說法不正確的是( )
| A.該合金中銅與鎂的物質的量之比是2:1 |
| B.該濃硝酸中HNO3的物質的量濃度是14.0 mol/L |
| C.NO2和N2O4的混合氣體中,NO2的體積分數是80% |
| D.得到2.54 g沉淀時,加入NaOH溶液的體積是600 mL |
 培優口算題卡系列答案
培優口算題卡系列答案 開心口算題卡系列答案
開心口算題卡系列答案 口算題卡河北少年兒童出版社系列答案
口算題卡河北少年兒童出版社系列答案科目:高中化學 來源: 題型:單選題
已知Cu+在酸性條件下能發生下列反應:Cu+ → Cu + Cu2+(未配平)。NH4CuSO3與足量的10mol·L-1硫酸溶液混合微熱,產生下列現象:①有紅色金屬生成 ②有刺激性氣味氣體產生 ③溶液呈藍色。據此判斷下列說法一定合理的是
| A.氣體是二氧化硫 | B.NH4CuSO3中銅元素全部被氧化 |
| C.反應后為硫酸銅溶液 | D.硫酸全部作氧化劑 |
查看答案和解析>>
科目:高中化學 來源: 題型:單選題
汽車劇烈碰撞時,安全氣囊中發生反應:10NaN3+2KNO3=K2O+5Na2O+16N2↑。則列判斷正確的是
| A.反應中KNO3為還原劑 |
| B.NaN3中氮元素為-3價 |
| C.標準狀況下,若有6.5gNaN3參加反應,則生成3.584L N2 |
| D.若1mol KNO,參加反應,轉移電子的物質的量為10mol |
查看答案和解析>>
科目:高中化學 來源: 題型:單選題
6g Mg、Cu合金與一定量的硝酸恰好完全反應,收集到標準狀況下VL NO和NO2的混合氣體。向反應后的溶液中加入足量NaOH溶液,得到沉淀12.12g。則V的值可能是
| A.2.688 | B.4.48 | C.8.064 | D.8.96 |
查看答案和解析>>
科目:高中化學 來源: 題型:單選題
某溶液中含有的溶質是FeBr2、FeI2,若先向該溶液中通入一定量的氯氣,再向反應后的溶液中滴加KSCN溶液,溶液變為紅色,則下列敘述正確的是( )
①原溶液中的Br-一定被氧化;②通入氯氣之后原溶液中的Fe2+一定有部分或全部被氧化;③不能確定通入氯氣后的溶液中是否存在Fe2+;④若取少量所得溶液,再加入CCl4,靜置、分液,向上層溶液中加入足量的AgNO3溶液,只產生白色沉淀,說明原溶液中的I-、Fe2+、Br-均被完全氧化。
| A.①②③ | B.②③④ | C.①③④ | D.①②③④ |
查看答案和解析>>
科目:高中化學 來源: 題型:單選題
檢驗海帶中碘元素的實驗中,發生如下反應:2H++2I-+H2O2=I2+2H2O,下列對該反應的敘述中不正確的是( )。
| A.I2為氧化產物 |
| B.H2O2既作氧化劑又作還原劑 |
| C.氧化性強弱順序為H2O2>I2 |
| D.生成1 mol I2時轉移2 mol電子 |
查看答案和解析>>
科目:高中化學 來源: 題型:單選題
在Cu2S+2Cu2O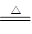 6Cu+SO2↑反應中,說法正確的是( )
6Cu+SO2↑反應中,說法正確的是( )
| A.Cu2O在反應中被氧化 |
| B.Cu2S在反應中既是氧化劑又是還原劑 |
| C.Cu既是氧化產物又是還原產物 |
| D.若反應中轉移12 mol電子,則生成6 mol Cu |
查看答案和解析>>
科目:高中化學 來源: 題型:單選題
有下列三個反應:
①Cl2+FeI2 FeCl2+I2
FeCl2+I2
②2Fe2++Br2 2Fe3++2Br-
2Fe3++2Br-
③Co2O3+6HCl 2CoCl2+Cl2↑+3H2O,
2CoCl2+Cl2↑+3H2O,
下列說法中正確的是( )
| A.①②③中氧化產物分別是FeCl2、Fe3+、Cl2 |
| B.根據以上方程式可以得到氧化性Cl2>Co2O3>Fe3+ |
| C.在反應③中生成1 mol Cl2時,有2 mol HCl被氧化 |
D.根據反應①②一定可以推理得到Cl2+FeBr2 FeCl2+Br2 FeCl2+Br2 |
查看答案和解析>>
科目:高中化學 來源: 題型:單選題
向CuSO4溶液中逐滴加入KI溶液至過量,觀察到產生白色沉淀CuI,藍色溶液變為棕色。再向反應后的溶液中通入過量的SO2氣體,溶液變成無色。則下列說法正確的是( )
| A.滴加KI溶液時,KI被氧化,CuI是氧化產物 |
| B.通入SO2后溶液逐漸變成無色,體現了SO2的漂白性 |
| C.通入22.4 L SO2參加反應時,有2NA個電子發生轉移 |
| D.上述實驗條件下,物質的氧化性:Cu2+>I2>SO2 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com