
【題目】氯氣是氯堿工業的主要產品之一,常作強氧化劑,可與有機物和無機物進行反應生成多種氯化物。某興趣小組在實驗室中對以下反應進行了探究。回答下列問題:
Ⅰ、三氯化硼(BCl3)的制備,

查閱資料:已知:①BCl3的沸點為12.5 ℃,熔點為-107.3 ℃; ②2B+6HCl ![]() 2BCl3↑+3H2↑;
2BCl3↑+3H2↑;
③BCl3遇水觀察到大量的白霧。
(1)檢驗發生裝置A的氣密性的實驗具體方法是_____________________________________
(2)按氣流方向連接各裝置的接口,順序為_______
a→( )→( )→( )→( )→( )→( )→ ( ) → ( ) →h。
(3)裝置D的作用是________________;裝置E的作用是___________________________,實驗中若不用裝置C,可能產生的后果是____________。
(4)BCl3遇水反應的化學方程式為:_____________________________。
Ⅱ、SO2與漂粉精溶液的反應
操作 | 現象 |
取4g 漂粉精固體,加入100mL 水,測漂粉精溶液的pH | pH 試紙先變藍(約為12),后褪色 |
| 1.液面上方出現白霧; 2.稍后,出現渾濁,溶液變為黃綠色; 3.稍后,產生大量白色沉淀,黃綠色褪去 |
(5)pH試紙顏色的變化說明漂粉精溶液具有的性質是_____________________________。
(6)現象2中溶液變為黃綠色的原因是:隨溶液酸性的增強,漂粉精的有效成分和Cl- 發生反應。該反應的離子方程式為________________________。
(7)用離子方程式解釋現象3中黃綠色褪去的原因_______________________。
【答案】 用彈簧夾夾住a處并關閉分液漏斗的活塞,向分液漏斗中加入蒸餾水,然后打開分液漏斗的活塞,觀察到水緩緩滴下甚至不滴,說明氣密性良好 e d j k b c(或cb) f g 液化BCl3使其從混合氣體中分離出來 吸收余氯防污染空氣,且防空氣中水蒸氣進入D中 B與HCl反應生成H2,H2、Cl2混合受熱發生爆炸 BCl3+3H2O=3HCl+H3BO3 堿性、漂白性 ClO-+Cl-+2H+=2H2O+Cl2↑ SO2+Cl2+2H2O+Ca2+=CaSO4↓+2Cl-+4H+(或SO2+Cl2+2H2O=SO42-+2Cl-+4H+)
【解析】Ⅰ、在加熱條件下,二氧化錳和濃鹽酸發生氧化還原反應生成Cl2,但濃鹽酸具有揮發性,水被加熱也能蒸發,升高溫度加快氯化氫和水蒸氣揮發,所以生成的Cl2中含有HCl、H2O,濃硫酸具有吸水性,飽和食鹽水能吸收Cl2,濃硫酸能干燥氣體,從而得到較純凈的Cl2,在B中制得BCl3,然后用D得到BCl3固體,為防止C中的水蒸氣進入D裝置使生成的BCl3水解,F中裝濃硫酸進行干燥,E吸收未反應的Cl2。
(1)檢驗發生裝置A的氣密性的實驗具體方法是用彈簧夾夾住a處并關閉分液漏斗的活塞,向分液漏斗中加入蒸餾水,然后打開分液漏斗的活塞,觀察到水緩緩滴下甚至不滴,說明氣密性良好,故答案為:用彈簧夾夾住a處并關閉分液漏斗的活塞,向分液漏斗中加入蒸餾水,然后打開分液漏斗的活塞,觀察到水緩緩滴下甚至不滴,說明氣密性良好;
(2)為了制備BCl3,依據的原理是3Cl2+2B![]() 2BCl3,所以裝置連接的順序應該為氣體發生裝置---除雜裝置--反應裝置--收集裝置--尾氣處理裝置的順序,又實驗室制備氯氣中夾雜有氯化氫和水,且應先除去HCl再除去水,按氣流方向連接各裝置的接口,順序為a→e→d→j→k→b→c→f→g→h,故答案為: e d j k b c(或cb) f g;
2BCl3,所以裝置連接的順序應該為氣體發生裝置---除雜裝置--反應裝置--收集裝置--尾氣處理裝置的順序,又實驗室制備氯氣中夾雜有氯化氫和水,且應先除去HCl再除去水,按氣流方向連接各裝置的接口,順序為a→e→d→j→k→b→c→f→g→h,故答案為: e d j k b c(或cb) f g;
(3)三氯化硼的沸點低,易揮發,需要冷卻產品,裝置D可以液化BCl3使其從混合氣體中分離出來;裝置E是一個盛有堿石灰的干燥管,其作用一方面是吸收未反應的多余氯氣,另一個方面也防止空氣中的水蒸氣進入U形管,C裝置是吸收Cl2中混有的HCl,由題給資料知,硼與氯化氫反應生成的產物中有氫氣,加熱氫氣和氯氣的混合氣體,易發生爆炸,故答案為:冷卻和收集三氯化硼;硼粉與氯化氫反應生成的產物中有氫氣,加熱氫氣與氯氣的混合氣體,易發生爆炸;故答案為:液化BCl3使其從混合氣體中分離出來;吸收余氯防污染空氣,且防空氣中水蒸氣進入D中;B與HCl反應生成H2,H2、Cl2混合受熱發生爆炸;
(4)因硼與鋁的性質相似,硼酸的化學式為H3BO3,類似鋁酸(H3AlO3),因三氯化硼遇水能反應,反應的化學方程式為:BCl3+3H2O=H3BO3+3HCl↑,故答案為:BCl3+3H2O=H3BO3+3HCl↑;
Ⅱ、(5)pH試紙先變藍(約為12),說明溶液呈堿性,后顏色褪去,說明又具有漂白性,故答案為:堿性;漂白性;
(6)漂粉精的有效成分是次氯酸鈣,次氯酸鈣與Cl- 發生氧化還原反應生成氯氣,反應的離子方程式為ClO-+Cl-+2H+=2H2O+Cl2↑,故答案為:ClO-+Cl-+2H+=2H2O+Cl2↑;
(7)溶液呈黃綠色,有Cl2生成,Cl2與SO2反應生成鹽酸與硫酸,反應方程式為:Cl2+SO2+2H2O=4H++2Cl-+SO42-,硫酸鈣微溶于水,也可以寫成SO2+Cl2+2H2O+Ca2+=CaSO4↓+2Cl-+4H+,故答案為:Cl2+SO2+2H2O═2Cl-+4H++SO42-(或SO2+Cl2+2H2O+Ca2+=CaSO4↓+2Cl-+4H+)。


科目:高中化學 來源: 題型:
【題目】銅鋅合金的顏色酷似金的顏色,所以近來用銅鋅合金制成的假金元寶欺騙行人的事件屢有發生。要檢驗市面上的金首飾是否為純金或者真金,可取樣品與一種試劑進行反應,根據現象即可判斷,所取的試劑是(王水是3份濃鹽酸和1份濃硝酸的混合物)( )
A.硫酸B.“王水”C.鹽酸D.硝酸
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某實驗小組同學進行如下實驗,以探究化學反應中的能量變化。
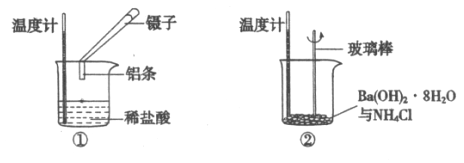
(1)實驗表明:②中的溫度降低,由此判斷氫氧化鋇晶體與氯化銨晶體反應是____________(填“吸熱”或“放熱”)反應。
(2)實驗①中,該小組同學在燒杯中加入5 mL 1.0 mol/L鹽酸,再放入用砂紙打磨過的鋁條,觀察產生H2的速率,如圖A所示,該反應是________(填“吸熱”或“放熱”)反應,其能量變化可用下圖中的___________(填“B”或“C”)表示。

A中0—t1段化學反應速率變化的原因是__________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】pH=1的某溶液X中僅含有NH4+、Al3+、Ba2+、Fe2+、Fe3+、CO32﹣、SO32﹣、SO42﹣、Cl﹣、NO3﹣中的一種或幾種(忽略水的電離及離子的水解),取該溶液進行連續實驗,實驗過程如圖:下列有關推斷不正確的是( )
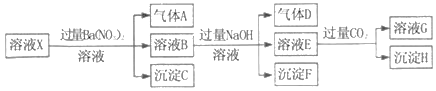
A. 溶液X中一定含有H+、Al3+、NH4+、Fe2+、SO42﹣
B. 根據上述連續實驗不能確定溶液X中是否含有Fe3+、Cl﹣
C. 沉淀H為Al(OH)3、BaCO3的混合物
D. 若溶液X為100mL,產生的氣體A為44.8mL(標準狀況),則X中c(Fe2+)=0.06molL﹣1
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】2016年IUPAC命名117號元素為TS(中文名![]() ,tián),TS的原子核外最外層電子數是7.下列說法不正確的是( )
,tián),TS的原子核外最外層電子數是7.下列說法不正確的是( )
A. TS是第七周期第ⅦA族元素 B. TS的同位素原子具有相同的電子數
C. TS在同族元素中非金屬性最弱 D. 中子數為176的TS核素符號是![]()
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列說法中,正確的是( )
①![]() 與
與![]() 是不同的核素,因此分別由這兩種原子構成的
是不同的核素,因此分別由這兩種原子構成的![]() 2與
2與![]() 2化學性質不同
2化學性質不同
②![]() 2、
2、![]() 2、
2、![]() 2互為同位素,
2互為同位素,![]()
③C60與12C、14C互為同位素
④科學家已發現了H3分子,H2與H3互為同素異形體
⑤稀土元素![]() 與
與![]() 的質量數不同,屬于兩種元素
的質量數不同,屬于兩種元素
⑥H2O與D2O互稱同素異形體
⑦![]() 和
和![]() 質子數相同,互為同位素
質子數相同,互為同位素
A. ④⑥ B. ③⑦ C. ②⑤ D. ④⑦
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】傳統的冰箱制冷劑“氟利昂”( CCl2F2)泄漏后臺破壞臭氧層.其反應過程可表示為:O3﹣→O+O2;Cl+O3→ClO+O2;ClO+O→Cl+O2 , 總反應為2O3→3O2 . 則上述臭氧變成氧氣的反應過程中,Cl原子的作用是( )
A.氧化劑
B.還原劑
C.催化劑
D.穩定劑
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在一個體積為2 L的密閉容器中,高溫下發生反應:Fe(s)+CO2(g) ![]() FeO(s)+CO(g)。其中CO2、CO的物質的量(mol)隨時間(min)的變化關系如圖所示。
FeO(s)+CO(g)。其中CO2、CO的物質的量(mol)隨時間(min)的變化關系如圖所示。
(1)反應在1 min時第一次達到平衡狀態,固體的質量增加了3.2 g。用CO2的濃度變化表示的反應速率v(CO2)=。
(2)反應進行至2 min時,若只改變溫度,曲線發生的變化如圖所示,3 min時再次達到平衡,則ΔH0(填“>”“<”或“=”)。
(3)5 min時再充入一定量的CO(g),平衡發生移動。下列說法正確的是(填寫編號)。
A.v(正)先增大后減小 B.v(正)先減小后增大
C.v(逆)先增大后減小 D.v(逆)先減小后增大
表示n(CO2)變化的曲線是(填寫圖中曲線的字母編號)。
(4)請用固態物質的有關物理量來說明該反應已經達到化學平衡狀態:。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】乙醛酸(HOOC-CHO)是有機合成的重要中間體。工業上用“雙極室成對電解法”生產乙醛酸,原理如圖所示。該裝置中陰、陽兩極為惰性電極,兩極室均可產生乙醛酸,其中乙二醛與M電極的產物反應生成乙醛酸。下列說法不正確的是

A.N電極上的電極反應式:HOOC-COOH+2e-+2H+=HOOC-CHO+H2O
B.若有2 mol H+ 通過質子交換膜并完全參與反應,則該裝置中生成的乙醛酸為1 mol
C.M電極上的電極反應式為:2Cl--2e-=Cl2↑
D.乙二醛與M電極的產物反應生成乙醛酸的化學方程式: Cl2+OHC-CHO+ H2O = HOOC-CHO+2HCl
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com