
【題目】由![]() 羥基丁酸生成
羥基丁酸生成![]() 丁內酯的反應如下:HOCH2CH2CH2COOH
丁內酯的反應如下:HOCH2CH2CH2COOH![]() +H2O
+H2O
在298K下,![]() 羥基丁酸水溶液的初始濃度為
羥基丁酸水溶液的初始濃度為![]() ,測得
,測得![]() 丁內酯的濃度隨時間變化的數據如表所示。回答下列問題:
丁內酯的濃度隨時間變化的數據如表所示。回答下列問題:
| 21 | 50 | 80 | 100 | 120 | 160 | 220 |
|
| 0.024 | 0.050 | 0.071 | 0.081 | 0.090 | 0.104 | 0.116 | 0.132 |
(1)該反應在50~80min內的平均反應速率為_____![]() 。
。
(2)120min時![]() 羥基丁酸的轉化率為______。
羥基丁酸的轉化率為______。
(3)298K時該反應的平衡常數![]() _____。
_____。
(4)為提高![]() 羥基丁酸的平衡轉化率,除適當控制反應溫度外,還可采取的措施是______。
羥基丁酸的平衡轉化率,除適當控制反應溫度外,還可采取的措施是______。
【答案】0.0007 0.5(50%) ![]() 將
將![]() 丁內酯移走
丁內酯移走
【解析】
(1)根據υ=![]() 計算反應速率;
計算反應速率;
(2)根據物質的轉化率=![]() 計算;
計算;
(3)根據化學平衡常數K=![]() 計算化學平衡常數;
計算化學平衡常數;
(4)根據影響化學平衡移動的因素,分析判斷。
(1) υ=![]() =
=![]() =0.0007mol/(Lmin);
=0.0007mol/(Lmin);
(2)在120min時反應產生的![]() 丁內酯的物質的量濃度0.090mol/L,則反應消耗的
丁內酯的物質的量濃度0.090mol/L,則反應消耗的![]() 羥基丁酸的濃度為0.090mol/L,由于反應開始時
羥基丁酸的濃度為0.090mol/L,由于反應開始時![]() 羥基丁酸的濃度0.180mol/L,所以
羥基丁酸的濃度0.180mol/L,所以![]() 羥基丁酸的轉化率為
羥基丁酸的轉化率為![]() =50%;
=50%;
(3)298K的攝氏溫度為25℃,水為液態,則此時該反應的平衡常數K=![]() =
=![]() =
=![]() ;
;
(4)為提高![]() 羥基丁酸的平衡轉化率,使化學平衡正向移動,除適當控制反應溫度外,還可采取的措施是及時分離出
羥基丁酸的平衡轉化率,使化學平衡正向移動,除適當控制反應溫度外,還可采取的措施是及時分離出![]() 丁內酯。
丁內酯。


科目:高中化學 來源: 題型:
【題目】將圖1所示裝置中的鹽橋(瓊脂-飽和![]() 溶液)換成銅導線與石墨棒連接得到圖2所示裝置,發現電流計指針仍然有偏轉。下列說法正確的是
溶液)換成銅導線與石墨棒連接得到圖2所示裝置,發現電流計指針仍然有偏轉。下列說法正確的是

A. 圖1中,鐵棒質量減少5.6g,則甲池![]() 溶液的質量增加5.6g
溶液的質量增加5.6g
B. 圖1中的石墨電極與圖2中乙池石墨![]() 電極的電極反應式相同
電極的電極反應式相同
C. 兩圖所示裝置的能量變化均是將化學能轉化為電能
D. 圖2中電子流向為![]() 電流計→石墨a→石墨b→銅絲→石墨c→
電流計→石墨a→石墨b→銅絲→石墨c→![]()
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某試液中只可能含有K+、NH4+、Fe2+、Al3+、Cl-、SO42-、CO32-、AlO2-中的若干種離子,離子濃度均為0.1mol/L,某同學進行了如下實驗:(已知:稀HNO3可與Fe2+發生氧化還原反應產生NO氣體,Fe2+被氧化為Fe3+),下列說法正確的是

A.無法確定原試液中是否含有Al3+、Cl-
B.濾液X中大量存在的陽離子有NH4+、Fe2+和Ba2+
C.原溶液中存在的離子為NH4+、Fe2+、Cl-、SO42-
D.無法確定沉淀C的成分
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】無機酸有機酯在生產中具有廣泛的應用,回答下列問題:
(1)硫酸氫乙酯( )可看作是硫酸與乙醇形成的單酯,工業上常通乙烯與濃硫酸反應制得,該反應的化學方程式為_________,反應類型為__________,寫出硫酸與乙醇形成的雙酯—硫酸二乙酯(
)可看作是硫酸與乙醇形成的單酯,工業上常通乙烯與濃硫酸反應制得,該反應的化學方程式為_________,反應類型為__________,寫出硫酸與乙醇形成的雙酯—硫酸二乙酯(![]() )的結構簡式_____。
)的結構簡式_____。
(2)磷酸三丁酯常作為稀土元素富集時的萃取劑,工業上常用正丁醇與三氯氧磷(![]() )反應來制備,該反應的化學方程式為__________,反應類型為________。寫出正丁醇的任意一個醇類同分異構體的結構簡式___________。
)反應來制備,該反應的化學方程式為__________,反應類型為________。寫出正丁醇的任意一個醇類同分異構體的結構簡式___________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】自門捷列夫發現元素周期律以來,人類對自然的認識程度逐步加深,元素周期表中的成員數目不斷增加。回答下列問題:
(1)2016年![]() 確認了四種新元素,其中一種為
確認了四種新元素,其中一種為![]() ,中文名為“
,中文名為“![]() ”。元素
”。元素![]() 可由反應:
可由反應:![]() +
+![]() =
=![]() +3
+3![]() 得到。該元素的質子數為______,
得到。該元素的質子數為______,![]() 與
與![]() 互為_________。
互為_________。
(2)![]() 位于元素周期表中第
位于元素周期表中第![]() 族,同族元素N的一種氫化物為NH2NH2,寫出該化合物分子的電子式________________.該分子內存在的共價鍵類型有_______。
族,同族元素N的一種氫化物為NH2NH2,寫出該化合物分子的電子式________________.該分子內存在的共價鍵類型有_______。
(3)該族中的另一元素P能呈現多種化合價,其中![]() 價氧化物的分子式為______,
價氧化物的分子式為______,![]() 價簡單含氧酸的分子式為______。
價簡單含氧酸的分子式為______。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】18-Ⅰ分子中只有兩種不同化學環境的氫,且數目比為3:2的化合物(________)
A. ![]() B.
B. ![]() C.
C. ![]() D.
D. ![]()
Ⅱ奧沙拉秦是曾用于治療急、慢性潰瘍性結腸炎的藥物,其由水楊酸為起始物的合成路線如下:
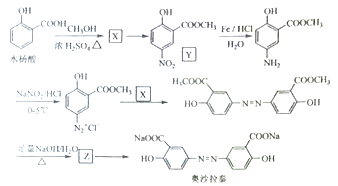
回答下列問題:
(1)X的結構簡式為____;由水楊酸制備X的反應類型為_____。
(2)由X制備Y的反應試劑為_________。
(3)工業上常采用廉價的![]() ,與Z反應制備奧沙拉秦,通入的
,與Z反應制備奧沙拉秦,通入的![]() 與Z的物質的量之比至少應為____。
與Z的物質的量之比至少應為____。
(4)奧沙拉秦的分子式為______,其核磁共振氫譜為______組峰,峰面積比為______。
(5)若將奧沙拉秦用![]() 酸化后,分子中含氧官能團的名稱為____。
酸化后,分子中含氧官能團的名稱為____。
(6)W是水楊酸的同分異構體,可以發生銀鏡反應;W經堿催化水解后再酸化可以得到對苯二酚。W的結構簡式為_______。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】如圖所示裝置(電極均為惰性電極)可吸收SO2,并用陰極排出的溶液吸收NO2。下列說法正確的是

A. N極的電極反應式為2HSO3-+2H++e-==S2O42-+2H2O
B. M極的電極反應式為SO2+2H2O-2e-==SO42-+4H+
C. 離子交換膜為陰離子交換膜
D. b為直流電源的正極
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】H2和 I2在一定條件下能發生反應:H2(g)+I2(g)![]() 2HI(g),1 mol H2 完全反應放出 akJ熱量。已知:(a、b、c 均大于零)。下列說法不正確的是
2HI(g),1 mol H2 完全反應放出 akJ熱量。已知:(a、b、c 均大于零)。下列說法不正確的是

A.反應物的總能量高于生成物的總能量
B.斷開 1 mol H—H 鍵和 1 mol I—I 鍵所需能量大于斷開 2 mol H—I 鍵所需能量
C.斷開 2 mol H—I 鍵所需能量約為(c+b+a)kJ
D.向密閉容器中加入 2 mol H2 和 2 mo l I2,充分反應放出的熱量小于 2a kJ
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】海水開發利用的部分過程如圖所示。下列有關說法不正確的是( )

A. 海水淡化的方法主要有蒸餾法、電滲析法、離子交換法等。
B. 空氣吹出法是工業規模海水提溴的常用方法。其工藝的其中一個環節是把氯氣通入酸化的濃縮海水(或苦鹵)中。
C. 稀有氣體(如氬)氛圍中和加熱條件下,可以用鎂與TiCl4反應得到鈦。
D. 在工業上一般選用氫氧化鈉溶液作為圖示中的沉淀劑。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com