
【題目】實驗室用下列儀器和藥品制取并收集干燥純凈的氯氣.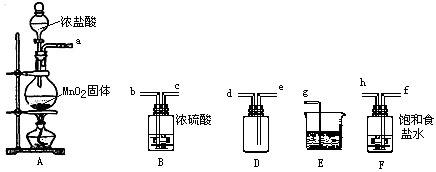
(1)盛有濃鹽酸的儀器名稱是 .
(2)按氣流從左到右,裝置正確的連接是:a 接、接、接、接(填各接口字母)
(3)裝置F 的作用是 , 裝置B 的作用是 .
(4)裝置E 中發生反應的化學方程式是 .
(5)裝置A 中發生反應的化學方程式是 , 若A 中有4.48L氯氣產生(標準狀態下),則參加反應的HCl有g.
【答案】
(1)分液漏斗
(2)f;h;b;c;e;d;g
(3)吸收氯化氫;吸收水干燥氯氣
(4)Cl2+2NaOH=NaCl+NaClO+H2O
(5)MnO2+4HCl(濃) ![]() ?MnCl2+Cl2↑+2H2O;29.2
?MnCl2+Cl2↑+2H2O;29.2
【解析】解:(1)盛有濃鹽酸的儀器為分液漏斗,所以答案是:分液漏斗;(2)實驗裝置的連接順序為:發生裝置→除雜裝置→收集裝置→尾氣處理裝置;A為氯氣的制取裝置,濃鹽酸與足量MnO2反應制取Cl2 , 反應需要加熱,氯化氫易揮發,所以制取的氯氣中含有水蒸氣和氯化氫,由于氯氣難溶于飽和食鹽水,可用飽和食鹽水除去氯化氫氣體,然后用濃硫酸干燥得到了干燥、純凈的氯氣,用向下排空氣法收集氯氣,最后要吸收多余的氯氣,即儀器連接順序為:a接f接h接b接c接e接d接g,所以答案是:f;h;b;c;e;d;g;(3)制取氯氣時需要加熱,會使濃鹽酸揮發出來,制取的氯氣中含有氯化氫和水蒸氣,Cl2不溶于飽和食鹽水,而HCl溶于飽和食鹽水,所以可以用裝置F使用飽和食鹽水除去HCl;濃硫酸具有吸水性,能夠干燥氯氣;所以答案是:吸收氯化氫;吸收水干燥氯氣;(4)裝置E用氫氧化鈉溶液吸收多余的氯氣,氯氣與氫氧化鈉溶液反應生成氯化鈉和次氯酸鈉和水,化學方程式:Cl2+2NaOH=NaCl+NaClO+H2O;所以答案是:Cl2+2NaOH=NaCl+NaClO+H2O;(5)二氧化錳與濃鹽酸在加熱條件下反應生成氯氣、氯化錳和水,化學方程式:MnO2+4HCl(濃) ![]() MnCl2+Cl2↑+2H2O; 設需要氯化氫質量為mg,依據方程式可知:
MnCl2+Cl2↑+2H2O; 設需要氯化氫質量為mg,依據方程式可知:
MnO2+4HCl(濃) ![]() MnCl2+Cl2↑+2H2O;
MnCl2+Cl2↑+2H2O;
4×36.5g 22.4L
m 4.48L
解得m=29.2g;
所以答案是:MnO2+4HCl(濃) ![]() MnCl2+Cl2↑+2H2O;29.2.
MnCl2+Cl2↑+2H2O;29.2.
【考點精析】關于本題考查的氯氣的實驗室制法,需要了解實驗室制法:MnO2+4HCl(濃)=MnCl2+Cl2↑+2H2O才能得出正確答案.


科目:高中化學 來源: 題型:
【題目】亞氯酸鈉(NaClO2)常用于水的消毒和砂糖、油脂的漂白與殺菌.以下是用過氧化氫法生產亞氯酸鈉的工藝流程圖: 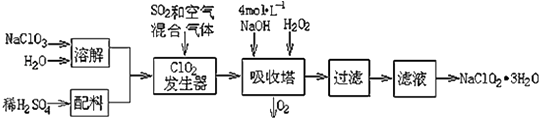
已知:①NaClO2的溶解度隨溫度升高而增大,適當條件下可結晶析出NaClO23H2O;
②Ksp(FeS)=6.3×10﹣18; Ksp(CuS)=6.3×10﹣36;Ksp(PbS)=2.4×10﹣28
(1)吸收塔內發生反應的離子方程式為 . 該工藝流程中的NaClO3、ClO2、NaClO2都是強氧化劑,它們都能和濃鹽酸反應制取Cl2 . 若用二氧化氯和濃鹽酸制取Cl2 , 當生成5mol Cl2時,通過還原反應制得氯氣的質量為g.
(2)從濾液中得到NaClO23H2O晶體的所需操作依次是(填寫序號). a.蒸餾 b.灼燒 c.過濾 d.冷卻結晶 e.蒸發
(3)印染工業常用亞氯酸鈉(NaClO2)漂白織物,漂白織物時真正起作用的是HClO2 . 表是 25℃時HClO2及幾種常見弱酸的電離平衡常數:
弱酸 | HClO2 | HF | HCN | H2S |
Ka | 1×10﹣2 | 6.3×10﹣4 | 4.9×10﹣10 | K1=9.1×10﹣8 |
①常溫下,物質的量濃度相等的NaClO2、NaF、NaCN、Na2S四種溶液的pH由大到小的順序為(用化學式表示);體積相等,物質的量濃度相同的NaF、NaCN兩溶液中所含陰陽離子總數的大小關系為:(填“前者大”“相等”或“后者大”).
②Na2S是常用的沉淀劑.某工業污水中含有等濃度的Cu2+、Fe2+、Pb2+離子,滴加Na2S溶液后首先析出的沉淀是;當最后一種離子沉淀完全時(該離子濃度為10﹣5molL﹣1),此時體系中的S2﹣的濃度為 .
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列離子方程式書寫正確的是( )
A.將碳與濃硫酸共熱反應后的氣體混合物通入過量氫氧化鈉溶液中CO2+SO2+3OH﹣=HSO3﹣+CO32﹣+H2O
B.向Ca(ClO)2溶液中通入二氧化硫 Ca2++2ClO﹣+SO2+H2O=2HClO+CaSO3↓
C.向Fe(NO3)3溶液中加入過量的HI溶液 2NO3﹣+8H++6I﹣=3I2+2NO↑+4H2O
D.將等體積等物質的量濃度的NaHCO3溶液與Ba(OH)2溶液混合HCO3﹣+Ba2++OH﹣=BaCO3↓+H2O
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】如圖的實驗裝置用來分離CO2和CO氣體并干燥.圖中a為止水夾,b為分液漏斗的活塞,通過Y形管和止水夾分別接c、d兩球膽,現裝置內的空氣已排盡.為使實驗成功,甲、乙、丙中盛放的溶液分別為( ) 
A.NaHCO3飽和溶液、12 molL﹣1 鹽酸,18.4 molL﹣1 H2SO4
B.Na2CO3飽和溶液、2 molL﹣1 H2SO4、NaOH飽和溶液
C.NaOH飽和溶液、2 molL﹣1 H2SO4、18.4 molL﹣1 H2SO4
D.18.4 molL﹣1 H2SO4、NaOH飽和溶液、18.4 molL﹣1 H2SO4
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】圖為反應2H2(g)+O2(g)=2H2O(g)的能量變化示意圖.下列說法正確的是( ) 
A.拆開2molH2(g)和1 molO2 (g)中的化學鍵成為H、O原子,共放出1368 kJ能量
B.由H、O原子形成2 molH2O(g),共吸收1852 kJ能量
C.2 molH2(g)和1 molO2(g)反應生成2 molH2O(1),共吸收484 kJ能量
D.2 molH2(g)和1 molO2 (g)反應生成2 moIH2O(g),共放出484 kJ能量
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某研究小組為探究影響過氧化氫分解的因素,做了三個實驗,相應的實驗結果如圖1所示(實驗1、 實驗2均在最適宜條件下進行,實驗3其他條件適宜),請分析回答:
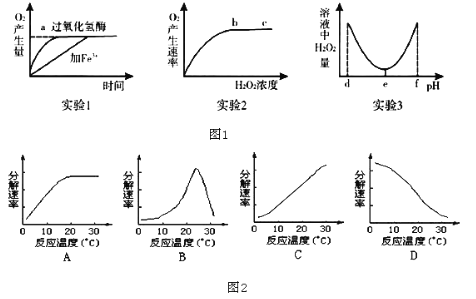
(1)實驗1,2,3中的自變量分別為______、______、______。
(2)實驗2結果反映,在b、c所對應的H2O2濃度范圍內,過氧化氫溶液濃度會______(填“升高”“降低”或“不影響”)過氧化氫酶的活性,bc段O2產生速率不再增大的原因最可能是______。
(3)實驗1若溫度升高到10℃,加過氧化氫酶的催化反應曲線斜率將______(填“增大”或“減小”);加Fe3+的催化反應曲線斜率將______(填“增大”或“減小”)。
(4)實驗3的結果顯示,過氧化氫酶的最適pH為______,實驗結果表明,當pH小于d或大于f時,過氧化氫的活性將永久喪失,其原因是______。
(5)如圖2能正確表示溫度對唾液淀粉酶活性影響曲線的是______。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】現有常溫時pH=1的某強酸溶液10mL,下列操作能使溶液的pH變成2的是( )
A.加入10mL 0.01molL﹣1的NaOH溶液
B.加入10mL 的水進行稀釋
C.加水稀釋成100mL
D.加入10mL 0.01molL﹣1的鹽酸溶液
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列說法不正確的是( )
A.乙烯與水反應制乙醇、乙醇與氧氣反應制乙醛都屬于加成反應
B.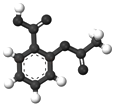 圖為阿司匹林的球棍模型,其分子式是C9H8O4
圖為阿司匹林的球棍模型,其分子式是C9H8O4
C.CH≡CH通過加聚反應可以得到結構片段為“…﹣CH=CH﹣CH=CH﹣…”的高分子化合物
D.往蛋白質溶液中加入飽和(NH4)2SO4溶液、CuSO4溶液都能產生沉淀,其原理不相同
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com