
【題目】根據下列化學反應和事實,說明反應利用了硫酸的什么性質,將表示性質的選項的字母填在各小題的橫線上.
A.不揮發性 B.酸性 C.吸水性 D.脫水性 E.強氧化性 F 強酸性
(1)濃硫酸可作氣體干燥劑___________________
(2)蔗糖中加濃![]() 產生“黑面包”現象__________________
產生“黑面包”現象__________________
(3)![]() (稀)=
(稀)=![]() _________________
_________________
(4)![]() _________________
_________________
【答案】C DE B E
【解析】
(1)濃硫酸具有吸水性,可用作干燥劑;
(2)濃硫酸具有脫水性,能使蔗糖碳化,濃硫酸與碳反應生成二氧化碳和二氧化硫,產生“黑面包”現象;
(3)Zn與稀H2SO4的反應實質是鋅與氫離子反應生成氫氣和鋅離子;
(4)碳與濃硫酸反應中,硫元素化合價降低,碳元素化合價升高。
(1)濃硫酸可作氣體干燥劑,體現濃硫酸的吸水性,故答案為:C;
(2)濃硫酸具有脫水性,能使蔗糖碳化,具有強氧化性的濃硫酸又與碳反應生成二氧化碳和二氧化硫,產生“黑面包”現象,故答案為:DE;
(3)Zn+H2SO4(稀)═ZnSO4+H2↑:反應的實質是鋅與氫離子反應生成氫氣和鋅離子,體現硫酸的酸性,故答案為:B;
(4)C+2H2SO4(濃)![]() 2SO2↑+2H2O+CO2↑,反應中濃硫酸中的硫元素化合價降低,所以濃硫酸只做氧化劑,表現氧化性,故答案為:E。
2SO2↑+2H2O+CO2↑,反應中濃硫酸中的硫元素化合價降低,所以濃硫酸只做氧化劑,表現氧化性,故答案為:E。


 小學生10分鐘應用題系列答案
小學生10分鐘應用題系列答案 目標測試系列答案
目標測試系列答案科目:高中化學 來源: 題型:
【題目】某溶液A中可能只含有Fe3+、Fe2+、Ag+、Mg2+、Al3+、NH4+、Cl-、NO3—、SO42—中的若干種離子,為確認其中含有的各離子,取1 L溶液A,進行如下所示實驗:
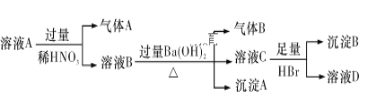
已知:氣體A、氣體B的體積都為2.24 L(標準狀況下),沉淀B的物質的量為0.1 mol。根據以上實驗操作與現象,判斷下列說法錯誤的是( )
A. 溶液A中一定含有Fe2+、NH4+、Ag+、NO3—,一定不含Cl-、SO42—
B. 沉淀A中一定含有Fe(OH)3,可能含有Mg(OH)2 、Al(OH)3
C. 溶液D中可能含有Al3+
D. 溶液A中的c(NO3—)≥1.0 mol/L
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某傳感器工作原理如圖所示。利用該傳感器可以測定空氣中NO、CO、NH3、SO2等有害氣體的含量。下列說法正確的是

A. 傳感器工作中,電子由Pt(Ⅰ)極經電流儀傳到Pt(Ⅱ)極
B. 若M為熔融KOH,X為NH3,Y為N2,則負極的電極反應式為2NH3-6e- = N2+6H+
C. 若M是含O2-的固體電解質,X為NO,則正極的電極反應式為O2 + 4e- = 2O2-
D. 若X為CO,M為KOH溶液,則電池總反應為2CO+O2 = 2CO2
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】常溫下,下列各組離子在指定的溶液中一定能大量共存的是
A. 能溶解![]() 的溶液中:
的溶液中:![]() 、
、![]() 、
、![]() 、
、![]()
B. 水電離出![]() 的溶液中:
的溶液中:![]() 、
、![]() 、
、![]() 、
、![]()
C. 滴入KSCN顯紅色的溶液:![]() 、
、![]() 、
、![]() 、
、![]()
D. ![]() 的溶液中:
的溶液中:![]() 、
、![]() 、
、![]() 、
、![]()
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列指定反應的離子方程式正確的是
A. 向![]() 溶液中滴加HI溶液:
溶液中滴加HI溶液:![]()
B. 用銅電極電解氯化鈉溶液:![]()
C. 向![]() 溶液中加入過量氨水:
溶液中加入過量氨水:![]()
D. 向![]() 溶液中滴加稀鹽酸:
溶液中滴加稀鹽酸:![]()
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在天平的左右兩個托盤上放有兩個燒杯,兩個燒杯中分別盛有鹽酸和氫氧化鈉溶液,天平處于平衡狀態,當分別向兩燒杯中加入等質量的鋁(酸和堿都是足量的)充分反應后
A. 天平保持平衡 B. 左高右低 C. 左低右高 D. 無法確定
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某化妝品的組分Z具有美白功效,原料從楊樹中提取,現可用如下反應制備:

下列敘述錯誤的是
A. X、Y和Z均能使溴水褪色,且原理相同
B. X和Z均能與Na2CO3溶液反應放出CO2
C. Z中含手性碳原子
D. Y可作加聚反應的單體,X可作縮聚反應的單體
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】二氧化錳是制造鋅錳干電池的基本材料,工業上以軟錳礦、菱錳礦為原料來制備。某軟錳礦主要成分為MnO2,還含有Si(16.27%)、Fe(5.86%)、Al(3.42%)、Zn(2.68%)和Cu(0.86%)等元素的化合物,其處理流程圖如下:

化合物 | Al(OH)3 | Fe(OH)2 | Fe(OH)3 |
Ksp近似值 | 10-35 | 10-6 | 10-38 |
(1)硫酸亞鐵在酸性條件下將MnO2還原為MnSO4,酸浸時發生的主要反應的化學方程式為______________________。
(2)“氨水、攪拌”,其中“攪拌”不僅能加快反應速率,還能___________;濾渣A的成分是Fe(OH)3、Al(OH)3,加入氨水需調節pH 至少達到____________,恰好能使Fe3+、A13+沉淀完全。(當離子濃度降到1.0×10-5mol·L-1時即視為沉淀完全)
(3)濾渣B的成分是___________________。
(4)MnO2也可在MnSO4-H2SO4-H2O為體系的電解液中電解獲得,其陽極電極反應式為_____________________________________________________。
(5)工業上采用間接氧化還原滴定法測定MnO2純度,其操作過程如下:準確稱量0.9200g該樣品,與足量酸性KI 溶液充分反應后,配制成100mL溶液。取其中20.00mL,恰好與25.00mL 0.0800mol·L-1Na2S2O3溶液反應(I2+2S2O32-=2I-+S4O62-)。計算可得該樣品純度_____%。(小數點后保留1位數字)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】化學與生活密切相關,下列說法不正確的是
A.為了防止食品受潮變質,常在食品包裝袋中放入生石灰
B.不可用鋁制餐具長時間存放酸性或堿性食物
C.明礬可用于凈水
D.為防止鐵制品生銹,可以在鐵制品的外層涂油漆或局部鍍銅
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com