
在一定條件下,可逆反應:mA+nB pC達到平衡,若:
pC達到平衡,若:
(1) A、B、C都是氣體,減少壓強,平衡向正反應方向移動,則m+n和p的大小關系是 ;
(2) A、C是氣體,若增加B的量,平衡不移動,則B應為 態;
(3) A、C是氣體,而且m+n = p,增大壓強可使平衡發生移動,則平衡移動的方向必是 。
(4) 加熱后,可使C的質量增加,則正反應是 反應(選填“放熱”或“吸熱”)。
(8分)(1) m+n<p (2)固態或(純)液態 (3)向左移動 (4)吸熱
解析試題分析:(1) 可逆反應:mA+nB pC達到平衡,若A、B、C都是氣體,減少壓強,平衡向正反應方向移動,這說明正方應是體積增大的可逆反應,所以m+n<p;
pC達到平衡,若A、B、C都是氣體,減少壓強,平衡向正反應方向移動,這說明正方應是體積增大的可逆反應,所以m+n<p;
(2) 可逆反應:mA+nB pC達到平衡,若A、C是氣體,若增加B的量,平衡不移動,這說明B應為固態或(純)液態;
pC達到平衡,若A、C是氣體,若增加B的量,平衡不移動,這說明B應為固態或(純)液態;
(3) 可逆反應:mA+nB pC達到平衡,若 A、C是氣體,而且m+n=p,增大壓強可使平衡發生移動,這說明A、B中至少有一種是固體或純液體,加壓平衡向逆反應方向移動,即平衡移動的方向必是向左移動;
pC達到平衡,若 A、C是氣體,而且m+n=p,增大壓強可使平衡發生移動,這說明A、B中至少有一種是固體或純液體,加壓平衡向逆反應方向移動,即平衡移動的方向必是向左移動;
(4) 加熱后,可使C的質量增加,這說明升高溫度平衡向正反應方向移動,因此正反應是吸熱反應。
考點:考查外界條件對平衡狀態的影響以及反應熱的判斷


科目:高中化學 來源: 題型:填空題
Ⅰ.課本中通過向草酸(H2C2O4)溶液中滴加用硫酸酸化高錳酸鉀中研究濃度對化學反應速率的影響,請你寫出該反應的化學方程式 ,該反應不需使用指示劑的原因是 ;
Ⅱ.某同學根據課本外界條件對化學反應速率的影響原理,設計了硫代硫酸鈉與硫酸反應有關實驗,實驗過程的數據記錄如下(見表格),請結合表中信息,回答有關問題:
| 實驗 序號 | 反應溫度 (℃) | 參加反應的物質 | ||||
| Na2S2O3 | H2SO4 | H2O | ||||
| V/mL | c/mol?L-1 | V/mL | c/mol?L-1 | V/mL | ||
| A | 20 | 10 | 0.1 | 10 | 0.1 | 0 |
| B | 20 | 5 | 0.1 | 10 | 0.1 | 5 |
| C | 20 | 10 | 0.1 | 5 | 0.1 | 5 |
| D | 40 | 5 | 0.1 | 10 | 0.1 | 5 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
在體積為10L的容器中,通人一定量的CO和H2O,在850℃時發生如下反應:
CO(g)十H2O(g)  CO2(g)十H2 (g) △H<0 , CO和H2O濃度變化如下圖,
CO2(g)十H2 (g) △H<0 , CO和H2O濃度變化如下圖,
(1) 3min—4min之間反應處于____狀態(填平衡、不平衡);
(2)要使反應在8min后,平衡向逆方向移動,可采取的措施是__ ___,要使反應在8min后,反應速率降低,平衡向正方向移動,可采取的措施是________。(填a,b,c,d)
a.增加水蒸氣 b.降低溫度 c.使用催化劑 d.增加氫氣濃度
(3)求出850℃ 時,該反應的平衡常數和CO的平衡轉化率(寫出詳細計算過程)
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
在某密閉容器內有正反應為放熱的可逆反應,其中A、B為氣體,C為固體,若反應開始經 s后達平衡。如圖:
s后達平衡。如圖:
(1)該反應的化學方程式為_________________________
(2)反應物的轉化率______________________
(3)要使反應物的轉化率增加可能的原因是____________
A.增大了B或C的濃度 B.使用了催化劑
C.縮小體積,使體系壓強增大 D.升高了反應溫度
(4)該反應達到平衡后,向該容器中再充入0.5mol的He。若恒溫恒壓,,這時反應速率 _________(填“加快”、“減慢”或“不變”),平衡_____________ (填“向正方向移動”、“向逆方向移動”、“不移動”);若恒溫恒容時,這時反應速率_______(填“加快”、“減慢”或“不變”),反應物的轉化率___________(填“加快”、“減慢”或“不變”)。
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
甲醇是重要的化學工業基礎原料和清潔液體燃料。工業上可利用CO或CO2來生產燃料甲醇。已知甲醇制備的有關化學反應以及在不同溫度下的化學反應平衡常數如下表所示:
| 化學反應 | 平衡常數 | 溫度℃ | |
| 500 | 800 | ||
①2H2(g)+CO(g) CH3OH(g) CH3OH(g) | K1 | 2.5 | 0.15 |
②H2(g)+CO2(g) H2O (g)+CO(g) H2O (g)+CO(g) | K2 | 1.0 | 2.50 |
③3H2(g)+CO2(g) CH3OH(g)+H2O (g) CH3OH(g)+H2O (g) | K3 | | |


查看答案和解析>>
科目:高中化學 來源: 題型:填空題
在一容積為2 L的密閉容器中,加入0.2 mol的N2和0.6 mol的H2,在一定條件下發生反應:N2(g)+3H2(g)  2NH3(g) ΔH<0 。反應中NH3的物質的量濃度的變化情況如下圖所示,請回答下列問題:
2NH3(g) ΔH<0 。反應中NH3的物質的量濃度的變化情況如下圖所示,請回答下列問題:
(1)根據上圖,計算從反應開始到平衡時,氫氣的平均反應速率v(H2)為______________。
(2)該反應達到平衡時N2的轉化率_________________。
(3)反應達到平衡后,第5分鐘末,保持其它條件不變,若改變反應溫度,則NH3的物質的量濃度不可能為____________。(填序號)
a.0.20 mol·L-1 b.0.12 mol·L-1 c.0.10 mol·L-1 d.0.08 mol·L-1
(4)請寫出該反應的平衡常數表達式_________,若該反應在298K、398K時的化學平衡常數分別為K1、K2,則K1 K2(填“>”、“="”" 或 “<” )。
(5)在第5分鐘末將容器的體積縮小一半后,若在第8分鐘末達到新的平衡(此時NH3的濃度約為0.25 mol·L-1),請在上圖中畫出第5分鐘末到此平衡時NH3濃度的變化曲線。
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
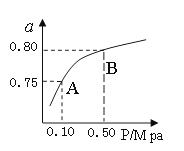
煤的液化是把固體煤炭通過化學加工過程,使其轉化成為液體燃料、化工原料和產品的先進潔凈煤技術,其中合成CH3OH是最重要的研究方向之一。在2L的密閉容器中,由CO2和H2合成甲醇CO2(g)+3H2(g) CH3OH(g)+H2O(g),在其他條件不變的情況下,探究溫度對反應的影響,實驗結果如下圖所示(注:T2>T1均大于300℃)。
CH3OH(g)+H2O(g),在其他條件不變的情況下,探究溫度對反應的影響,實驗結果如下圖所示(注:T2>T1均大于300℃)。
①通過分析上圖,可以得出對反應CO2(g)+3H2(g) CH3OH(g)+H2O(g)的說法正確的是(填
CH3OH(g)+H2O(g)的說法正確的是(填
序號) 。
| A.該反應為放熱反應 |
| B.T1時的反應速率大于T2時的反應速率 |
| C.該反應在T1時的平衡常數比T2時的大 |
| D.處于A點的反應體系從T1變到T2,達平衡時n(H2)/n(CH3OH)增大 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
向某密閉容器中加入0.15mol/L A、0.05mol/L C和一定量的B三種氣體。一定條件下發生反應,各物質濃度隨時間變化如下圖中甲圖所示[t0時c( B)未畫出,t1時增大到0.05mol/L]。乙圖為 t2時刻后改變反應條件,平衡體系中正、逆反應速率隨時間變化的情況。
(1)若t4時改變的條件為減小壓強,則B的起始物質的量濃度為 mol/L;
該反應的平衡常數表達式為K= 。
(2)若t5時改變的條件是升溫,此時v(正) > v(逆),平衡常數K的值將 (選填“增大”、“減小”或“不變”)。
(3)若 t1= 15s,則t0~ t1階段以C 濃度變化表示的平均反應速率為v(C)=
mol/L·s。t3時改變的某一反應條件可能是 (選填序號)。
a.使用催化劑 b.增大壓強 c.增大反應物濃度 d.降低產物濃度
(4)若A的物質的量減少0.02mol時,容器與外界的熱交換總量為a kJ,寫出該反應的熱化學方程式 。
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
碘及其化合物在生產、生活中具有廣泛的用途。解答下列與碘元素有關的試題:
(1)碘是人體中的微量元素之一,是一種智力元素。國家推廣“加碘食鹽”,其中一般加入的是KIO3,而不是KI。其原因是 。
(2)常溫下,NH4I是一種固體,一定溫度下在密閉容器中發生下面的反應:
① NH4I(s) 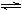 NH3(g) + HI(g)
NH3(g) + HI(g)
② 2HI(g) 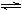 H2(g) + I2(g)
H2(g) + I2(g)
達到平衡時,縮小容器體積,增大體系壓強,混合氣體的顏色 (填“加深”或“變淺”或“不變”);達到平衡時,反應②的化學平衡常數表達式為 ;達到平衡時c(H2)=0.5mol/L,反應①的化學平衡常數為20,則 c (HI) = 。
(3)如圖,在粗試管中加入飽和的KI溶液,然后再加入苯,插入兩根石墨電極,接通直流電源。連接電源負極的電極為 極,電極反應式為 。通電一段時間后,斷開電源,振蕩試管,上層溶液為 色。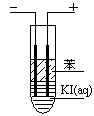
(4)已知Ksp(PbI2)=7.1×10-9mol3/L3。在盛有澄清的PbI2飽和溶液的試管中,滴加濃度為0.1mol/L的碘化鉀溶液,振蕩,可以觀察到溶液中有黃色渾濁產生,這些黃色渾濁的成分是 。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com