
 CH3OH(g)
CH3OH(g)
| A.升高溫度 |
| B.將CH3OH(g)從體系中分離 |
| C.充入He,使體系總壓強(qiáng)增大 |
| D.再充入1 mol CO和2 mol H2 |

 BaCO3(s)+SO42-(aq)。
BaCO3(s)+SO42-(aq)。 CH3OH(g) △H=-91kJ/mol (3分,方程式含狀態(tài)符號(hào)正確給1分;反應(yīng)熱2分,其中單位寫錯(cuò)扣1分,但結(jié)果或符號(hào)寫錯(cuò)不給分,可逆符號(hào)也可以寫成等號(hào))
CH3OH(g) △H=-91kJ/mol (3分,方程式含狀態(tài)符號(hào)正確給1分;反應(yīng)熱2分,其中單位寫錯(cuò)扣1分,但結(jié)果或符號(hào)寫錯(cuò)不給分,可逆符號(hào)也可以寫成等號(hào))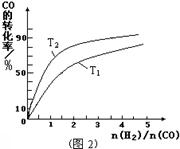
 BaCO3 + SO42-
BaCO3 + SO42-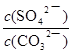 =
=  = 4.0×10-2(2分,單位無(wú)寫不扣分)
= 4.0×10-2(2分,單位無(wú)寫不扣分) CH3OH(g) △H=-91kJ/mol;(2)由于正反應(yīng)是放熱反應(yīng),其它條件相同時(shí),升高溫度平衡向逆反應(yīng)方向移動(dòng),則CO平衡轉(zhuǎn)化率減小,故A錯(cuò)誤;甲醇是生成物,從平衡體系移走生成物,減小生成物濃度,平衡向正反應(yīng)方向移動(dòng),反應(yīng)物平衡轉(zhuǎn)化率增大,故B正確;由于容器容積不變,雖然充入氦氣增大壓強(qiáng),但是平衡體系各組分的物質(zhì)的量、物質(zhì)的量濃度均不變,所以平衡不能移動(dòng),反應(yīng)物平衡轉(zhuǎn)化率保持不變,故C錯(cuò)誤;再充入1molCO和2molH2,就是增大壓強(qiáng),由于正反應(yīng)是氣體體積減小的反應(yīng),增大壓強(qiáng)平衡向正反應(yīng)方向移動(dòng),反應(yīng)物的平衡轉(zhuǎn)化率增大,故D正確;(3)讀圖,橫坐標(biāo)表示氫氣和一氧化碳的起始組成比,縱坐標(biāo)表示CO的平衡轉(zhuǎn)化率;當(dāng)氫氣和一氧化碳的起始組成比為0時(shí),CO的平衡轉(zhuǎn)化率為0;當(dāng)氫氣和一氧化碳的起始組成比相同且不為零時(shí),由于正反應(yīng)是放熱反應(yīng),降低溫度平衡向正反應(yīng)方向移動(dòng),CO的平衡轉(zhuǎn)化率增大;當(dāng)氫氣和一氧化碳的起始組成比增大時(shí),增大氫氣的濃度,平衡向正反應(yīng)方向移動(dòng),CO的平衡轉(zhuǎn)化率增大;根據(jù)上述要點(diǎn)作圖,可以畫出溫度為T2時(shí),CO的平衡轉(zhuǎn)化率隨氫氣和一氧化碳的起始組成比變化的示意圖;(4)設(shè)硫酸鋇溶解的物質(zhì)的量為xmol,由于BaSO4 + CO32-
CH3OH(g) △H=-91kJ/mol;(2)由于正反應(yīng)是放熱反應(yīng),其它條件相同時(shí),升高溫度平衡向逆反應(yīng)方向移動(dòng),則CO平衡轉(zhuǎn)化率減小,故A錯(cuò)誤;甲醇是生成物,從平衡體系移走生成物,減小生成物濃度,平衡向正反應(yīng)方向移動(dòng),反應(yīng)物平衡轉(zhuǎn)化率增大,故B正確;由于容器容積不變,雖然充入氦氣增大壓強(qiáng),但是平衡體系各組分的物質(zhì)的量、物質(zhì)的量濃度均不變,所以平衡不能移動(dòng),反應(yīng)物平衡轉(zhuǎn)化率保持不變,故C錯(cuò)誤;再充入1molCO和2molH2,就是增大壓強(qiáng),由于正反應(yīng)是氣體體積減小的反應(yīng),增大壓強(qiáng)平衡向正反應(yīng)方向移動(dòng),反應(yīng)物的平衡轉(zhuǎn)化率增大,故D正確;(3)讀圖,橫坐標(biāo)表示氫氣和一氧化碳的起始組成比,縱坐標(biāo)表示CO的平衡轉(zhuǎn)化率;當(dāng)氫氣和一氧化碳的起始組成比為0時(shí),CO的平衡轉(zhuǎn)化率為0;當(dāng)氫氣和一氧化碳的起始組成比相同且不為零時(shí),由于正反應(yīng)是放熱反應(yīng),降低溫度平衡向正反應(yīng)方向移動(dòng),CO的平衡轉(zhuǎn)化率增大;當(dāng)氫氣和一氧化碳的起始組成比增大時(shí),增大氫氣的濃度,平衡向正反應(yīng)方向移動(dòng),CO的平衡轉(zhuǎn)化率增大;根據(jù)上述要點(diǎn)作圖,可以畫出溫度為T2時(shí),CO的平衡轉(zhuǎn)化率隨氫氣和一氧化碳的起始組成比變化的示意圖;(4)設(shè)硫酸鋇溶解的物質(zhì)的量為xmol,由于BaSO4 + CO32-  BaCO3 + SO42-中各物質(zhì)的系數(shù)之比等于物質(zhì)的量之比,則碳酸根離子、硫酸根離子的變化物質(zhì)的量均為xmol,由于飽和碳酸鈉溶液的體積為1L,由于c=n/V,則碳酸根離子、硫酸根離子的變化物質(zhì)的量濃度均為xmol/L,由此推斷該可逆反應(yīng)中有關(guān)組分的(起始、變化、平衡)濃度,則:
BaCO3 + SO42-中各物質(zhì)的系數(shù)之比等于物質(zhì)的量之比,則碳酸根離子、硫酸根離子的變化物質(zhì)的量均為xmol,由于飽和碳酸鈉溶液的體積為1L,由于c=n/V,則碳酸根離子、硫酸根離子的變化物質(zhì)的量濃度均為xmol/L,由此推斷該可逆反應(yīng)中有關(guān)組分的(起始、變化、平衡)濃度,則: BaCO3 + SO42-
BaCO3 + SO42-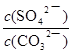 =
=  = 4.0×10-2
= 4.0×10-2


| 年級(jí) | 高中課程 | 年級(jí) | 初中課程 |
| 高一 | 高一免費(fèi)課程推薦! | 初一 | 初一免費(fèi)課程推薦! |
| 高二 | 高二免費(fèi)課程推薦! | 初二 | 初二免費(fèi)課程推薦! |
| 高三 | 高三免費(fèi)課程推薦! | 初三 | 初三免費(fèi)課程推薦! |
科目:高中化學(xué) 來(lái)源:不詳 題型:填空題
| A.增大的CO濃度 | B.增大的H2O(g)濃度 | C.使用催化劑 | D.降低溫度 |
查看答案和解析>>
科目:高中化學(xué) 來(lái)源:不詳 題型:填空題
| 化學(xué)式 | HF | H2CO3 | HClO |
| 電離平衡常數(shù) (Ka) | 7.2×10-4 | K1=4.4×10-7 K2=4.7×10-11 | 3.0×10-8 |
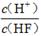 D.
D.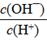
查看答案和解析>>
科目:高中化學(xué) 來(lái)源:不詳 題型:推斷題
 X(g);△H=-dJ·mol-1(d>0,X為A、B、C三種元素組成的一種化合物)。初始投料與各容器達(dá)到平衡時(shí)的有關(guān)數(shù)據(jù)如下:
X(g);△H=-dJ·mol-1(d>0,X為A、B、C三種元素組成的一種化合物)。初始投料與各容器達(dá)到平衡時(shí)的有關(guān)數(shù)據(jù)如下:| 實(shí)驗(yàn) | 甲 | 乙 | 丙 |
| 初始投料 | 2 molA2、1 molBC | 1 molX | 4 molA2、2 molBC |
| 平衡時(shí)n(X) | 0.5mol | n2 | n3 |
| 反應(yīng)的能量變化 | 放出Q1kJ | 吸收Q2kJ | 放出Q3kJ |
| 體系的壓強(qiáng) | P1 | P2 | P3 |
| 反應(yīng)物的轉(zhuǎn)化率 | α1 | α2 | α3 |

查看答案和解析>>
科目:高中化學(xué) 來(lái)源:不詳 題型:填空題
 2CO(g)+2H2(g)。平衡體系中各組分體積分?jǐn)?shù)如下表:
2CO(g)+2H2(g)。平衡體系中各組分體積分?jǐn)?shù)如下表:| 物質(zhì) | CH4 | CO2 | CO | H2 |
| 體積分?jǐn)?shù) | 0.1 | 0.1 | 0.4 | 0.4 |
 2CO(g)+2H2(g) 的△H= 。
2CO(g)+2H2(g) 的△H= 。
查看答案和解析>>
科目:高中化學(xué) 來(lái)源:不詳 題型:計(jì)算題
 2NH3(g) △H<0。某實(shí)驗(yàn)將3.0 mol N2(g)和4. 0 mol H2(g)充入容積為10L的密閉容器中,在溫度T1下反應(yīng)。測(cè)得H2的物質(zhì)的量隨反應(yīng)時(shí)間的變化如下圖所示。
2NH3(g) △H<0。某實(shí)驗(yàn)將3.0 mol N2(g)和4. 0 mol H2(g)充入容積為10L的密閉容器中,在溫度T1下反應(yīng)。測(cè)得H2的物質(zhì)的量隨反應(yīng)時(shí)間的變化如下圖所示。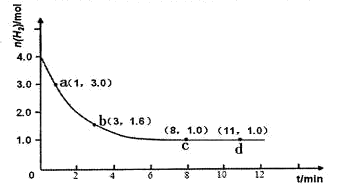

 CH3COO[Cu(NH3)3]?CO △H<0。寫出提高CO吸收率的其中一項(xiàng)措施: 。
CH3COO[Cu(NH3)3]?CO △H<0。寫出提高CO吸收率的其中一項(xiàng)措施: 。查看答案和解析>>
科目:高中化學(xué) 來(lái)源:不詳 題型:計(jì)算題
 Fe3O4(s)+4H2(g) △H=akJ/mol (I)
Fe3O4(s)+4H2(g) △H=akJ/mol (I) 6FeO(s)+O2(g) △H=bkJ/mol (II)
6FeO(s)+O2(g) △H=bkJ/mol (II)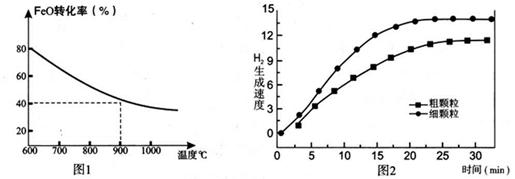
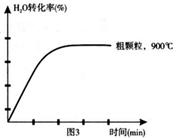
查看答案和解析>>
科目:高中化學(xué) 來(lái)源:不詳 題型:單選題
| A.若A2和B2的總能量之和大于生成的2AB的總能量,則反應(yīng)放熱 |
| B.若A2和B2的總能量之和小于生成的2AB的總能量,則反應(yīng)放熱 |
| C.若該反應(yīng)為放熱反應(yīng),則Q1+Q2 < Q3 |
| D.若該反應(yīng)為吸熱反應(yīng),則Q1+Q2 < Q3 |
查看答案和解析>>
科目:高中化學(xué) 來(lái)源:不詳 題型:單選題
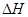 的絕對(duì)值均正確)
的絕對(duì)值均正確)| A.C2H5OH(l)+3O2(g)==2CO2(g)+3H2O(g);△H=—1367.0 kJ/mol(燃燒熱) |
| B.NaOH(aq)+HCl(aq)==NaCl(aq)+H2O(l);△H=+57.3kJ/mol(中和熱) |
| C.S(s)+O2(g)===SO2(g);△H=—269.8kJ/mol(反應(yīng)熱) |
| D.2NO2==O2+2NO;△H=+116.2kJ/mol(反應(yīng)熱) |
查看答案和解析>>
國(guó)際學(xué)校優(yōu)選 - 練習(xí)冊(cè)列表 - 試題列表
湖北省互聯(lián)網(wǎng)違法和不良信息舉報(bào)平臺(tái) | 網(wǎng)上有害信息舉報(bào)專區(qū) | 電信詐騙舉報(bào)專區(qū) | 涉歷史虛無(wú)主義有害信息舉報(bào)專區(qū) | 涉企侵權(quán)舉報(bào)專區(qū)
違法和不良信息舉報(bào)電話:027-86699610 舉報(bào)郵箱:58377363@163.com