
【題目】A、B、C、D是原子序數小于20的四種元素,已知A元素+1價的陽離子與B、D的陰離子具有相同的電子層結構,B元素最高正價與負價的絕對值之差等于6.lmolC單質與足量的稀硫酸反應可生成1.5molH2 , 反應后C元素原子形成的離子和氖原子的電子層結構相同.D元素原子的最外層電子數是C元素原子的最外層電子數的2倍. 試回答:
(1)A,B,C,D四種元素依次是(寫出元素名稱).
(2)寫出A與C、B與D最高價氧化物的水化物的化學式(按酸性或堿性由強至弱的順序)
(3)寫出A,C兩元素最高價氧化物的水化物間反應的化學方程式
(4)請用電子式表示化合物A2O的形成過程: .
【答案】
(1)鉀、氯、鋁、硫
(2)堿性:KOH>Al(OH)3 , 酸性:HClO4>H2SO4
(3)KOH+Al(OH)3=KAlO2+2H2O
(4)![]()
【解析】解:A、B、C、D是原子序數小于20的四種元素,B元素最高正價的絕對值與負價的絕對值之差等于6,則B為第ⅦA族元素,F元素沒有正化合價,所以B為氯元素;A元素+1價的陽離子與B、D的陰離子具有相同的電子層結構,即核外電子數為18,則A為K元素;lmolC單質與足量的稀硫酸反應可生成1.5molH2 , 則C為金屬,根據電子轉移守恒可知,C原子最外層電子數為3,可推知C為Al;D元素原子的最外層電子數是C元素原子的最外層電子數的2倍,故D原子最外層電子數為6,D離子核外電子數為18,則D為S元素.(1)由上述分析可知,A、B、C、D四種元素依次是:鉀、氯、鋁、硫, 所以答案是:鉀、氯、鋁、硫(2)A與C最高價氧化物對應水化物分別為KOH、Al(OH)3 , 金屬性K>Al,故堿性:KOH>Al(OH)3 ,
B與D最高價氧化物的水化物分別為HClO4、H2SO4 , 非金屬性Cl>S,故酸性:HClO4>H2SO4 ,
所以答案是:堿性:KOH>Al(OH)3 , 酸性:HClO4>H2SO4;
·(3)A與C最高價氧化物對應水化物分別為KOH、Al(OH)3 , 二者反應生成偏鋁酸鉀與水,反應方程式為:KOH+Al(OH)3=KAlO2+2H2O,
所以答案是:KOH+Al(OH)3=KAlO2+2H2O;(4)用電子式表示化合物K2O的形成過程: ![]() ,
,
所以答案是: ![]() .
.


 全能測控期末小狀元系列答案
全能測控期末小狀元系列答案科目:高中化學 來源: 題型:
【題目】草酸是基本有機合成原料,廣泛用于醫藥、冶金和化工等部門。某校課外小組的同學擬利用乙炔合成H2C2O4·2H2O。回答下列問題:
(1)甲組的同學擬用電石(主要成分CaC2,含CaS和Ca3P2等雜質)制取C2H2[反應方程式為CaC2 +2H2O=Ca(OH)2 +C2H2(g) △H<0,該反應劇烈],實驗裝置如下:
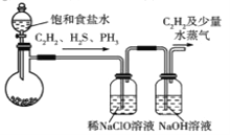
A B C
①裝置A中,為減小產生乙炔的速率,除用飽和食鹽水代替水外,還可采取的措施是_____(舉一例)。
②裝置A中,Ca3P2與水反應的化學方程式為_______________________________________;
裝置B中,NaClO被還原為氯化鈉,反應過程中還有極少量Cl2生成。寫出H2S被NaClO溶液氧化為硫酸的主要反應的離子方程式:___________________________。
③裝罝C中NaOH溶液的作用是___________________________________________________。
(2)乙組的同學擬用甲組制取的乙炔與濃硝酸在Hg(NO3)2催化下反應,并經結晶和重結晶得H2C2O4·2H2O。制備裝置如下:
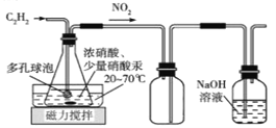
D E F
①裝置D中多孔球泡的作用是___________________________________________;裝置E的作用是__________________________________________________________;
②裝置D生成H2C2O4 反應的化學方程式為______________________________________。
(3)丙組的同學擬設計實驗證明草酸具有還原性。簡單的實驗方案為_____________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】A、B、C、D、E是中學化學中五種常見元素,有關信息如下:
元素 | 有關信息 |
A | 最高價氧化物對應的水化物與其氫化物反應生成離子化合物 |
B | 地殼中含量最多的元素 |
C | 單質須保存在煤油中 |
D | 單質與NaOH溶液反應可用于生產漂白液 |
E | 單質是生活中用量最大的金屬,其制品在潮濕空氣中易被腐蝕或損壞 |
請回答下列問題:
(1)A的氫化物分子的電子式是 , 其最高價氧化物對應的水化物與其氫化物反應的離子方程式: .
(2)B,C組成的某種化合物和B的某種氫化物反應可生成B的單質,則B、C組成的該化合物所含有的化學鍵為 .
(3)A、D的氫化物相互反應,產生白色固體,對該固體中陽離子存在檢驗的操作方法及現象是: , 證明存在該陽離子.
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列各組晶體類型完全不一樣的一組是( )
A.CaO,NO,CO
B.CCl4、H2O2、He
C.CO2、SiO2、NaCl
D.CH4、O2、Na2O
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】中國科學院長春應用化學研究所在甲醇燃料電池技術方面獲得新突破,組裝出了自呼吸電池及主動式電堆.甲醇燃料電池的工作原理如圖所示. 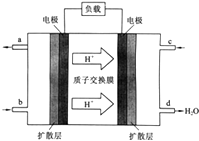
①該電池工作時,b口通入的物質為 , c口通入的物質為 .
②該電池負極的電極反應式為: .
③工作一段時間后,當12.8g甲醇完全反應生成CO2時,有NA個電子轉移.
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】同溫、同壓下等質量的SO2氣體和CO2氣體,下列有關比較的敘述中,正確的是①密度比為16:11 ②密度比為11:16 ③體積比為16:11 ④體積比為11:16( )
A.①③
B.①④
C.②③
D.②④
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】利用下列裝置和操作不能達到實驗目的的是( )
|
|
|
|
A.從含碘CCl4溶液中提取碘和回收CCl4溶劑 | B.萃取操作過程中的放氣 | C.定量測定化學反應速率 | D.比較KMnO4、Cl2、S的氧化性 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某溫度時,在2L的密閉容器中,X、Y、Z(均為氣體)三種物質的量隨時間的變化曲線如圖所示. 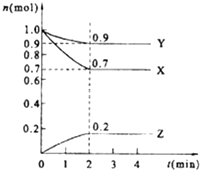
(1)由圖中所給數據進行分析,該反應的化學方程式為;
(2)反應從開始至2分鐘,用Z的濃度變化表示的平均反應速率為v(Z)=;
(3)將a mol X與b mol Y的混合氣體發生上述反應,反應到某時刻各物質的量恰好滿足: n (X)=n (Y)=n (Z),則原混合氣體中a:b= .
(4)下列措施能加快反應速率的是(多選).
A.恒壓時充入He
B.恒容時充入He
C.恒容時充入X
D.及時分離出Z
E.升高溫度
F.選擇高效的催化劑
(5)下列說法正確的是(單選).
A.升高溫度改變化學反應的限度
B.已知正反應是吸熱反應,升高溫度平衡向右移動,正反應速率加快,逆反應速率減慢
C.化學反應的限度是不可能改變的
D.增大Y的濃度,正反應速率加快,逆反應速率減慢.
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com