
工業廢水中常含有一定量的Cr2O72-和CrO42-,它們會對人類及生態系統產生很大損害,必須進行處理。常用的處理方法有兩種。
方法1:還原沉淀法。該法的工藝流程為CrO42-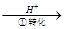 Cr2O72-
Cr2O72-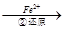 Cr3+
Cr3+ Cr(OH)3↓
Cr(OH)3↓
其中第①步存在平衡:2CrO42- (黃色)+2H+ Cr2O72- (橙色)+H2O
Cr2O72- (橙色)+H2O
(1)若平衡體系的pH=2,該溶液顯________色。
(2)能說明第①步反應達平衡狀態的是__________。
a.Cr2O72-和CrO42-的濃度相同
b.2v(Cr2O72-)=v(CrO42-)
c.溶液的顏色不變
(3)第②步中,還原1 mol Cr2O72-離子,需要________mol的FeSO4·7H2O。
(4)第③步生成的Cr(OH)3在溶液中存在以下沉淀溶解平衡:Cr(OH)3(s)  Cr3+(aq)+3OH-(aq),常溫下,Cr(OH)3的溶度積Ksp=c(Cr3+)·c3(OH-)=10-32,要使c(Cr3+)降至10-5mol/L,溶液的pH應調至_______。
Cr3+(aq)+3OH-(aq),常溫下,Cr(OH)3的溶度積Ksp=c(Cr3+)·c3(OH-)=10-32,要使c(Cr3+)降至10-5mol/L,溶液的pH應調至_______。
方法2:電解法。該法用Fe做電極電解含Cr2O72-的酸性廢水,隨著電解進行,在陰極附近溶液pH升高,產生Cr(OH)3沉淀。
(5)用Fe做電極的原因為__________________。
(6)在陰極附近溶液pH升高的原因是(用電極反應解釋)_________________________________。溶液中同時生成的沉淀還有__________。
(11分)(1)橙 (1分)(2)c (1分) (3)6 (2分)(4)5 (2分)
(5)陽極反應為Fe-2e-=Fe2+,提供還原劑Fe2+ 2分 (6)2H++2e-=H2↑ ,Fe(OH)3 (3分)
解析試題分析:(1)若平衡體系的pH=2,這說明溶液顯酸性,氫離子濃度增大,因此平衡正反應方向移動,所以該溶液顯橙色。
(2)在一定條件下,當可逆反應的正反應速率和逆反應速率相等時(但不為0),反應體系中各種物質的濃度或含量不再發生變化的狀態,稱為化學平衡狀態。平衡時各種物質的濃度不再發生變化,但各種物質的濃度之間不一定滿足某種關系,a不能說明;速率之比是相應的化學計量數之比,因此b中的關系始終是成立,不能說明,b不正確;顏色的深淺和濃度有關系,因此當溶液有色不再發生變化時,可以說明反應達到平衡狀態,c正確,答案選c。
(3)在反應②中Cr元素的化合價從+6價降低到+3價,得到3個電子。鐵元素的化合價從+2價升高到+3價,上去1個電子,則根據電子得失守恒可知n(Cr2O72-)×6=n(FeSO4?7H2O)×1,解得n(FeSO4?7H2O)=6mol。
(4)根據溶度積常數的表達式Ksp=c(Cr3+)·c3(OH—)=10-32可知,當溶液中c(Cr3+)=10-5mol/L時,溶液的c(OH-)=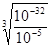 =10-9 mol/L,因此c(H+)=
=10-9 mol/L,因此c(H+)=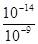 =10-5mol/L,所以pH=5,即要使c(Cr3+)降至10-5mol/L,溶液的pH應調至5。
=10-5mol/L,所以pH=5,即要使c(Cr3+)降至10-5mol/L,溶液的pH應調至5。
(5) Cr2O72—要生成Cr(OH)3沉淀,必需有還原劑,而鐵做電極時,在陽極上可以失去電子產生Fe2+,電極反應式為Fe-2e-=Fe2+。
(6)在電解池中陽離子在陰極得到電子,在溶液中由于H+得電子得能力強于Fe2+的,因此陰極是H+放電,電極反應式為2H++2e-=H2↑。隨著電解的進行,溶液中的H+濃度逐漸降低,水的電離被促進,OH-濃度逐漸升高。由于Fe2+被Cr2O72—氧化生成Fe3+,當溶液堿性達到一定程度時就會產生Fe(OH)3沉淀。
考點:考查外界條件對平衡狀態的影響、可逆反應平衡狀態的判斷、氧化還原反應的有關計算、溶度積常數的有關計算以及電化學原理的應用和電極反應式的書寫等
點評:該題是中等難度的試題,也是高考中的常見題型和考點。試題綜合性強,難易適中,側重對學生能力的培養和解題方法的指導與訓練,有助于培養學生的邏輯推理能力和發散思維能力。注意相關知識的積累和總結,并能靈活運用即可。


 開心蛙口算題卡系列答案
開心蛙口算題卡系列答案科目:高中化學 來源: 題型:填空題
有兩個密閉容器A和B,A容器中有一個移動的活塞能使容器內保持恒壓,B容器能保持恒容。起始時向這兩個容器中分別充入等量的體積比為2:l的SO2和O2的混合氣體,并使A和B容積相等(如圖所示),在保持400℃的溫度下使之發生如下反應:2SO2+O2 2SO3。填寫下列空白:
2SO3。填寫下列空白:
(1)SO2的轉化率α(A) α(B)。(填“<”、“>”或“=”)
(2)達到(1)所述平衡時,若向兩容器中通入少量的氬氣,A容器化學平衡 移動。(填“正向”、“逆向”或“不”)
(3)達到(1)平衡后,向容器中充入等量的原反應氣體,再次達到平衡后,B容器中SO3在混合氣體中的體積分數 。(填“增大”、“減小”或“不變”)
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
Cl2合成有機物時會產生副產物HC1。4HCl+O2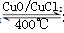 2Cl2+2H2O,可實現氯的循環利用。
2Cl2+2H2O,可實現氯的循環利用。
完成下列填空:
(1)該反應平衡常數的表達式K= ;若反應容器的容積為2L,8min后達到平衡,測得容器內物質由2.5mol減少至2.25mol,則HCl的平均反應速率為 mol/L? min。
(2)若該反應在體積不變的密閉容器中發生,當反應達平衡時,下列敘述正確的是 。
a.v (HCl)="2" v(Cl2)
b.4v正(HCl)= v逆(O2)
c.又加入1mol O2,達新平衡時,HCl的轉化率增大
d.分離出H2O,達新平衡時,v正(HCl)增大
(3)下圖是該反應兩種投料比[n (HCl):n (O2)分別為4:1和2:1 ] 下,反應溫度對HCl平衡轉化率影響的曲線。下列敘述正確的是 。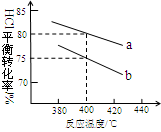
a.該反應的正反應是放熱反應
b.其他條件不變,升高溫度,平衡常數K值增大
c.若平衡常數K值變大,達新平衡前v逆始終減小
d.若平衡常數K值變大,則平衡向正反應方向移動
(4)投料比為4:1、溫度為400℃時,平衡混合物中Cl2的物質的量分數是 。
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
鉛及其化合物工業生產及日常生活具有非常廣泛的用途。
(1)瓦紐科夫法熔煉鉛,其相關反應的熱化學方程式如下:
2PbS(s)+3O2(g)=2PbO(s)+2SO2(g) ΔH=" a" kJ/mol
PbS(s)+2PbO(s)=3Pb(s)+SO2(g) ΔH=" b" kJ·mol-1
PbS(s)+PbSO4(s)=2Pb(s)+2SO2(g) ΔH=" c" kJ·mol-1
反應3PbS(s) + 6O2(g) = 3PbSO4(s) ΔH="kJ" ·mol-1(用含a,b ,c的代數式表示)。
(2)還原法煉鉛,包含反應PbO(s)+CO(g)  Pb(s) + CO2(g) ΔH,該反應的平衡常數的對數值與溫度的關系如下表
Pb(s) + CO2(g) ΔH,該反應的平衡常數的對數值與溫度的關系如下表
| 溫度 | 300 | 727 | 1227 |
| lgK | 6.17 | 2.87 | 1.24 |



查看答案和解析>>
科目:高中化學 來源: 題型:填空題
(Ⅰ)銅鐵及其化合物在日常生活中應用廣泛,某研究性學習小組用粗銅(含雜質Fe)與過量氯氣反應得固體A,用稀鹽酸溶解A,然后加試劑調節溶液的pH后得溶液B,溶液B經系列操作可得氯化銅晶體,請回答:
(1)固體A用稀鹽酸溶解的原因是 ;
(2)檢驗溶液B中是否存在Fe3+的方法是 ;
(3)已知元素在高價態時常表現氧化性,若在酸性CuSO4溶液中加入一定量的Na2SO3和NaCl溶液,加熱,生成CuCl沉淀,則生成CuCl的離子方程式是 ;
(Ⅱ)(1) 常溫下,某同學將稀鹽酸與氨水等體積混合,兩種溶液的濃度和混合后所得溶液的pH如下表:
| 實驗編號 | 氨水物質的量濃度 (mol·L-1) | 鹽酸物質的量濃度 (mol·L-1) | 混合溶液 pH |
| ① | 0.1 | 0.1 | pH=5 |
| ② | C | 0.2 | pH=7 |
| ③ | 0.2 | 0.1 | pH>7 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
I.煤化工中常需研究不同溫度下平衡常數、投料比等問題。
已知:CO (g) +H2O(g) H2(g) +CO2(g)平衡常數K隨溫度的變化如下表:
H2(g) +CO2(g)平衡常數K隨溫度的變化如下表:
回答下列問題
(1)該反應的平衡常數表達式K=______,ΔH=______0(填“<”、“>”、“=”)
(2)已知在一定溫度下,CCs) +CO2(g) 2C0 Cg)平衡常數K1;
2C0 Cg)平衡常數K1;
C (s) +H2O(g) CO Cg) +H2(g)平衡常數K2
CO Cg) +H2(g)平衡常數K2
則K、K1 、K2,之間的關系是______:
(3)8000C時,向一個10L的恒容反應器中充入0.40molCO和1.60mol水蒸氣,經一段時 間后反應達到平衡,此時CO的轉化率為:若保持其他條件不變,向平衡體系中 再通入0.10molCO和0.40molCO2,此時v正______v逆 (填“>”、“=”或“<”)。
II.某小組利用H2C2O4溶液和酸性KMnO4溶液反應來探究“條件對化學反應速率的影響”。
(4) 向酸性KmnO4溶液中加入一定量的H2C2O4溶液,當溶液中的KmnO4耗盡后,紫色溶液將褪去。為確保能觀察到紫色褪去,H2C2O4與KmnO4初始的物質的量需要滿足的關 系為n(H2C2O4): n(KMnO4) ______。
(5) 為探究反應物濃度對化學反應速率的影響,該小組設計了如下實驗方案
表中x= ______ml ,理由是______。
(6) 已知50°C時,濃度c(H2C2O4)隨反應時間t的變化曲線如圖示,若保持其他條件不變,請在答題卡坐標圖 中畫出25°C時c(H2C2O4)隨t的變化曲線示意圖。
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
在一個固定體積的密閉容器中,向容器中充入2 mol A 和1 mol B,發生如下反應:2A(g) + B(g)  3C(g) + D(s),反應達到平衡時C的濃度為1.2 mol/L.
3C(g) + D(s),反應達到平衡時C的濃度為1.2 mol/L.
(1)若使容器溫度升高,平衡時混合氣體的平均相對摩爾質量減小,則正反應為________(填“吸熱”或“放熱”)反應.
(2)若維持容器體積和溫度不變,按下列方法加入起始物質,達到平衡時C的濃度仍為1.2 mol/L的是______(用序號填空).
①4 mol A+2 mol B ②3 mol C+1 mol D+l mol B
③3 mol C+2 mol D ④1.6 mol A+0.8 mol B+0.6 mol C
(3)某溫度下,向容器中加入3 mol C和0.8 mol D,反應達到平衡時C的濃度仍為1.2 mol/L,則容器的容積V應大于________L,小于________L.
查看答案和解析>>
科目:高中化學 來源: 題型:問答題
(14分)研究CO2與CH4的反應使之轉化為CO和H2,對減緩燃料危機,減少溫室效應具有重要的意義。
(1)已知:①2CO(g)+O2(g)=2CO2(g) △H=-566 kJ·mol-1
②2H2(g)+O2(g)=2H2O(g) △H=-484kJ·mol-1
③CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H=-802kJ·mol-1
則CH4(g)+CO2(g)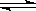 2CO(g)+2H2(g) △H= kJ·mol-1
2CO(g)+2H2(g) △H= kJ·mol-1
(2)在密閉容器中通入物質的量濃度均為0.1mol·L-1的CH4與CO2,在一定條件下發生反應CH4(g)+CO2(g) 2CO(g)+2H2(g),測得CH4的平衡轉化率與溫度、壓強的關系如下圖所示。
2CO(g)+2H2(g),測得CH4的平衡轉化率與溫度、壓強的關系如下圖所示。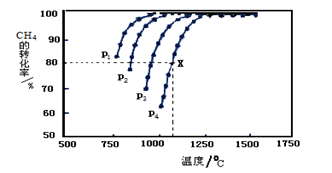
?據圖可知,P1、P2、 P3、P4由大到小的順序 。
?在壓強為P4、1100℃的條件下,該反應5min時達到平衡點X,則用CO表示該反應的速率為 。該溫度下,反應的平衡常數為 。
(3)CO和H2在工業上還可以通過反應C(s)+H2O(g)  CO(g)+H2 (g)來制取。
CO(g)+H2 (g)來制取。
①在恒溫恒容下,如果從反應物出發建立平衡,可認定平衡已達到的是
| A.體系壓強不再變化 | B.H2與CO的物質的量之比為1 :1 |
| C.混合氣體的密度保持不變 | D.氣體平均相對分子質量為15,且保持不變 |
查看答案和解析>>
科目:高中化學 來源: 題型:計算題
在一定條件下,在容積為2L的密閉容器中,將2mol氣體M和3mol氣體N混合,發生如下反應:2M(g)+ 3N(g)  x Q(g)+3R(g),經2min達平衡,生成2.4molR,并測得Q的濃度為0.4mol/L。求:
x Q(g)+3R(g),經2min達平衡,生成2.4molR,并測得Q的濃度為0.4mol/L。求:
(1)用氣體M來表示該反應的化學反應速率是多少?
(2)反應前后的壓強比是多少?
(3)N的轉化率是多少?
(4)平衡時氣體Q所占的體積分數為多少?
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com