
【題目】鎂及其合金廣泛應用于航空航天、交通、電池等行業。
已知:CaO(s)+3C(s)=CaC2(s)+CO(g) △H= +464 kJ·mol-1
MgO(s)+ CaC2(s)=CaO(s)+ Mg(g)+2C(s) △H =+177.5 kJ·mol-1
(1)鎂可以在二氧化碳中燃燒,寫出化學反應方程式_____________________。
(2)寫出MgO(s)與C(s)生成1 mol CO(g)和氣態鎂的熱化學方程式:________________。
(3) 用電解法制取鎂時,若原料氯化鎂含有水時,在電解溫度下,原料會形成Mg(OH)Cl,并發生電離反應:Mg(OH)Cl=Mg(OH)++Cl-。電解時在陰極表面會產生氧化鎂鈍化膜,此時陰極的反應式為________________。
(4)鎂/間二硝基苯電池工作時鎂轉變為氫氧化鎂,間二硝基苯則轉變為間二苯胺。間二硝基苯、間二苯胺的結構簡式和鎂/間二硝基苯電池的裝置如下:
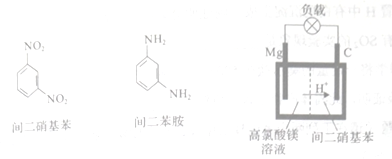
該電池放電時的正極反應方程式為___________________。
【答案】 2Mg+CO2![]() 2MgO + C MgO(s)+C(s)=CO(g)+Mg(g) △H=+641.5 J·mol-1 2Mg(OH)++2e-=2MgO+H2↑
2MgO + C MgO(s)+C(s)=CO(g)+Mg(g) △H=+641.5 J·mol-1 2Mg(OH)++2e-=2MgO+H2↑ 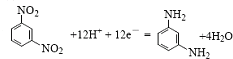
【解析】本題主要考查鎂的性質。
(1)鎂可以在二氧化碳中燃燒,反應的化學方程式為2Mg+CO2![]() 2MgO + C。
2MgO + C。
(2)將上述兩個熱化學方程式相加合可得MgO(s)與C(s)生成1 mol CO(g)和氣態鎂的熱化學方程式:MgO(s)+C(s)=CO(g)+Mg(g) △H=+641.5 J·mol-1。
(3) 此時陰極上陽離子 Mg(OH)+被還原,產生氧化鎂和氫氣,反應式為2Mg(OH)++2e-=2MgO+H2↑。
(4) 該電池放電時的正極反應方程式為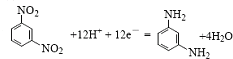 。
。


 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源: 題型:
【題目】草酸是植物(特別是草本植物)常具有的成分,具有廣泛的用途。草酸晶體(H2C2O4·2H2O)無色,熔點為101℃,易溶于水,受熱易脫水、升華,170℃以上分解。常溫下它的電離常數K1=5.4×10-2,K2=5.4×10-5。回答下列問題:
I.擬用下列裝置分解草酸制備少量純凈的CO,其合理的連接順序為________(填字母序號)。
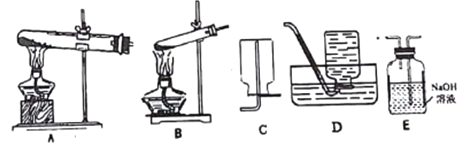
Ⅱ.設計實驗證明草酸為弱酸的方案及其現象均正確的有______(填序號)。
A.室溫下,取0.010mol/L的H2C2O4溶液,測其pH=2;
B.室溫下,取0.010mol/L的NaHC2O4溶液,測其pH>7;
C. 室溫下,取pH=a(a<3)的H2C2O4溶液稀釋100倍后,測其pH
D.標況下,取0.10mol/L的H2C2O4溶液100mL與足量鋅粉反應,收集到H2體積為224mL
Ⅲ.醫學上常用酸性KMnO4溶液和草酸(H2C2O4)溶液反應來測血液中血鈣的含量。測定方法是:取2mL血液用蒸餾水稀釋后.向其中加入足量的(NH4)2C2O4溶液,反應生成CaC2O4沉淀,將沉淀用稀硫酸溶解得到H2C2O4后,再用KMnO4溶液滴定。
①溶解沉淀時______(填“能”或“不能”)用稀鹽酸,原因是_________。
②滴定時,用______(填“酸”或“堿”)式滴定管裝KMnO4溶液,滴定達到終點的現象是______。
③ 滴定過程中發生的離子反應方程式______________。
④ 若上述滴定中消耗了1.0×10-4mol/LKMnO4的溶液20mL,則200mL該血液中含鈣_____g。
⑤ 下列操作會引起測定結果偏高的是__________(填序號)
A.滴定管在盛裝KMnO4溶液前未潤洗
B.滴定過程中,錐形瓶振蕩的太劇烈,以致部分液體濺出
C.滴定前讀數正確,滴定終點時俯視讀數
D.裝待測液的錐形瓶用蒸餾水洗滌后,沒用待測液沖洗
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某固體混合物可能由NaCl、NaI、NH4Cl、Na2CO3、Na2SO3、Na2SO4中的一種或幾種組成,準確稱取4.7g該固體混合物進行如下實驗(所加試劑均足量,氣體體積己折算成標準狀況):

根據實驗結果,下列有關說法不正確的是
A. 原固體混合物中是否含有NaC1無法確定
B. 原固體混合物中必含有NH4Cl、Na2CO3、Na2SO3
C. 測定出“白色沉淀3”的質量可以確定混合物的組成
D. 若溶液1中只加BaCl2,則生成白色沉淀的質量必小于6.63g
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】砷及其化合物用途非常廣泛。回答下列問題:
(1)砷與磷同主族,原子序數比磷大18,則砷位于周期表第________周期__________族。
(2) H3AsO3(亞砷酸),是三元弱酸,第一步和第二步電離通過和水中的氫氧根結合實現的,第三步則直接電離出H+。第一步電離方程式為:H3AsO3+H2O![]() [As(OH)4]-+H+,第二步的電離方程式為______________。
[As(OH)4]-+H+,第二步的電離方程式為______________。
(3)古代《本草衍義》提純砒霜作如下敘述:“將生砒就置火上,以器覆之,令砒煙上飛,著覆器,遂凝結,累然下垂如乳尖……,”該提純用的基本操作______________。近年來發現砒霜(As2O3)可用于治療白血病。砷黃鐵礦(FeAsS)煅燒可生成砒霜和紅棕色固體,該反應的化學方程式為__________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】化學與生產、生活密切相關。下列有關說法錯誤的是( )
A.氮氣化學性質不活潑,可用作食品防腐劑
B.石英是良好的半導體材料,可以制成光電池,將光能直接轉化成電能
C.疫苗一般應冷藏存放,以避免蛋白質變性
D.家庭裝修時用水性漆替代傳統的油性漆,有利于健康及環境
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com