
【題目】汽車尾氣的主要成分有CO、SO2、氮氧化物等,科研工作者目前正在嘗試以二氧化鈦(TiO2)催化分解汽車尾氣的研究。
(1)已知:2NO(g)+O2(g)=2NO2(g) ΔH1=-113.0KJ/mol
2SO2(g)+O2(g)=2SO3(1) ΔH2=-288.4KJ/mol
N2(g) + O2(g) = 2NO(g) △ H3=+180.5 kJ·mol-1
請判斷反應NO2(g)+SO2(g)=NO(g)+SO3(1) ΔH4,在低溫下能否自發進行,并說明理由______________________。
(2)已知TiO2催化尾氣降解原理為:2CO(g)+O2(g) ![]() 2CO2(g); 2H2O(g)+4NO(g)+O2(g)
2CO2(g); 2H2O(g)+4NO(g)+O2(g) ![]() 4HNO3(g)。
4HNO3(g)。
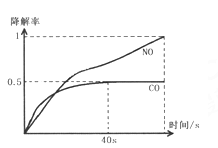
Ⅰ.在O2濃度幾乎不變的條件下,模擬CO、NO的降解,得到降解率隨時間變化如圖1所示(![]() ),反應40秒后檢測HNO3氣體濃度有所降低,請用化學方程式結合化學反應原理知識解釋出現該現象可能的原因_______________________。
),反應40秒后檢測HNO3氣體濃度有所降低,請用化學方程式結合化學反應原理知識解釋出現該現象可能的原因_______________________。
Ⅱ.圖2為在不同顆粒間隙的瀝青混凝土(α、β型)和不同溫度下,實驗進行相同一段時間(t秒)后測得的CO降解率變化,回答謝列問題:
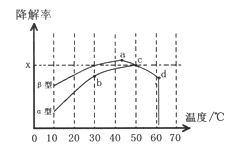
①已知50℃、t秒時容器中O2濃度為0.01mol/L,求此溫度下CO降解反應的平衡常數_______。
②下列關于圖2的敘述不正確的是_________
A.根據降解率由b點到c點隨溫度的升高而增大,可知CO降解反應的平衡常數Kb<Kc
B.相同溫度下β型瀝青混凝土中CO降解速率比α型要大
C.a點的數據反映出CO與O2之間所發生的有效碰撞頻率是整個實驗過程中最高的
D.d點降解率出現突變的原因可能是溫度升高后催化劑失效
③科研團隊以β型瀝青混凝土顆粒為載體,將TiO2改為催化效果更好的TiO2納米管,在10-60℃范圍內進行實驗,請在圖2中用線段與陰影仿照“示例”描繪出CO降解率隨溫度變化的曲線可能出現的最大區域范圍(示例:![]() )。________________________
)。________________________
(3)TiO2納米管的制備是在弱酸性水溶液中以金屬鈦為陽極進行電解,寫出陽極的電極反應式_______。
【答案】 經計算ΔH4=(113.0-288.4)×0.5=-87.7KJ/mol<0,且可判斷反應的ΔS<0,故在低溫下可自發進行 40秒后發生反應2NO=N2+O2生成氮氣,并且NO濃度降低,平衡2H2O+4NO+O2![]() 4HNO3逆向移動,造成HNO3濃度降低
4HNO3逆向移動,造成HNO3濃度降低 ![]() AC
AC  Ti-4e-+2H2O=TiO2+4H+
Ti-4e-+2H2O=TiO2+4H+
【解析】試題分析:(1)根據△H-T△S判斷;Ⅰ. 40秒后發生反應2NO=N2+O2生成氮氣,并且NO濃度降低;據此分析平衡移動;Ⅱ. ①根據平衡常數表達式計算;②根據影響反應速率和反應限度的因素分析;(3)陽極失電子發生氧化反應;
解析:(1)①2NO(g)+O2(g)=2NO2(g) ΔH1=-113.0kJ/mol
②2SO2(g)+O2(g)=2SO3(1) ΔH2=-288.4kJ/mol
根據蓋斯定律②×![]() -①×
-①×![]() 得 NO2(g)+SO2(g)=NO(g)+SO3(1) ΔH3=(113.0-288.4)×0.5=-87.7kJ/mol;氣體物質的量減少,ΔS<0,ΔH<0,根據△H-T△S<0能自發進行,所以在低溫下可自發進行;(2)Ⅰ.40秒后發生反應2NO=N2+O2生成氮氣,并且NO濃度降低,NO濃度降低使平衡2H2O+4NO+O2
得 NO2(g)+SO2(g)=NO(g)+SO3(1) ΔH3=(113.0-288.4)×0.5=-87.7kJ/mol;氣體物質的量減少,ΔS<0,ΔH<0,根據△H-T△S<0能自發進行,所以在低溫下可自發進行;(2)Ⅰ.40秒后發生反應2NO=N2+O2生成氮氣,并且NO濃度降低,NO濃度降低使平衡2H2O+4NO+O2![]() 4HNO3逆向移動,造成HNO3濃度降低;Ⅱ. ①設初始CO的濃度為a mol/L,
4HNO3逆向移動,造成HNO3濃度降低;Ⅱ. ①設初始CO的濃度為a mol/L,


![]() ;
;
②A.根據降解率由b點到c點隨溫度的升高而增大,b點不是平衡狀態,故A錯誤;
B. 根據圖示,相同溫度下β型瀝青混凝土反應速率快,故B正確;
C.溫度越高,有效碰撞頻率越高,故C錯誤;
D.在適宜的溫度下催化劑的效果最好,故D正確;
③催化劑加快反應速率,所以10℃、t秒時就達到平衡,根據升高溫度平衡轉化率降低,可得圖像如下
(3)以金屬鈦為陽極進行電解,陽極失電子發生氧化反應,生成TiO2,陽極的電極反應式為Ti-4e-+2H2O=TiO2+4H+。


 津橋教育計算小狀元系列答案
津橋教育計算小狀元系列答案科目:高中化學 來源: 題型:
【題目】原子序數依次遞增且都小于36的X、Y、Z、Q、W五種元素,其中X是原子半徑最小的元素,Y原子基態時最外層電子數是其內層電子數的2倍,Q原子基態時2p原子軌道上有2個未成對的電子,W元素的原子結構中3d能級有4個未成對電子。回答下列問題:
(1)Y2X2分子中Y原子軌道的雜化類型為 ,Y2X2分子中σ鍵和π鍵個數比為 。
(2)化合物ZX3的沸點比化合物YX4的高,其主要原因是 。
(3)元素Y的一種氧化物與元素Z的一種氧化物互為等電子體,元素Z的這種氧化物的分子式是 。
(4)元素W能形成多種配合物,如:W(CO)5等。
①基態W3+的M層電子排布式為 。
②W(CO)5常溫下呈液態,熔點為—20.5℃,沸點為103℃,易溶于非極性溶劑,據此可判斷W(CO)5晶體屬于 晶體(填晶體類型),該晶體中W的化合價為 。
(5)下列有關的說法正確的是 。
A.分子晶體中,共價鍵鍵能越大,該分子晶體的熔沸點越高
B.電負性順序:X<Y<Z<Q
C.因為晶格能CaO比KCl高,所以KCl比CaO熔點低
D.H2 YO3的分子結構中含有一個非羥基氧,故其為中強酸
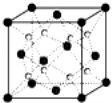
(6)Q和Na形成的一種只含有離子鍵的離子化合物的晶胞結構如圖4,距一個陰離子周圍最近的所有陽離子為頂點構成的幾何體為 。已知該晶胞密度為ρ g/cm3,阿伏加德羅常數為NA,求晶胞邊長a= pm。(用含ρ、NA的計算式表示)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】用50mL0.50mol/L鹽酸與50mL0.55mol/LNaOH溶液在如圖所示的裝置中進行中和反應。通過測定反應過程中所放出的熱量可計算中和熱。回答下列問題:
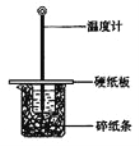
(1)從實驗裝置上看,圖中尚缺少的一種玻璃儀器是 。
(2)大燒杯上如不蓋硬紙板,求得的中和熱數值 (填“偏大、偏小、無影響”)
(3)如果用60mL0.50mol/L鹽酸與50mL0.55mol/LNaOH溶液進行反應,與上述實驗相比,所放出的熱量 (填“相等、不相等”),所求中和熱△H_____ (填“相等、不相等”)
(4)如果用相同濃度和體積的氨水代替NaOH溶液進行上述實驗,所求的中和熱△H會 (填“偏大”、“偏小”、“無影響”) 若用KOH代替NaOH,實驗所測的熱量會_________________(填“偏大”、“偏小”、“無影響”)。
(5)他們記錄的實驗數據如下:
實驗用品[ | 溶液溫度 | 中和熱 △H | |||
起始平 均溫度 | 反應最高溫度 | ||||
① | 50mL,0.55mol.L-1NaOH | 50mL,0.5mol.L-1HCl | 20℃ | 23.3℃ | |
② | 50mL,0.55mol.L-1NaOH | 50mL,0.5mol.L-1HCl | 20℃ | 23.5℃ | |
已知反應后溶液的比熱容C為4.18KJ·℃-1· Kg-1,各物質的密度均視為1g·cm-3。
①根據上表數據計算中和熱△H=__________(保留至小數點后一位)
②根據實驗結果寫出NaOH溶液與HCl溶液反應的熱化學方程式: 。
(6)上述實驗數值結果與57.3 kJ/mol有偏差,產生偏差的原因可能是(填字母)_______________。
A.實驗裝置保溫、隔熱效果差
B.量取稀鹽酸溶液的體積時仰視讀數
C.一次性把NaOH溶液倒入盛有鹽酸的小燒杯中
D.用溫度計測定NaOH溶液起始溫度后直接測定HCl溶液的溫度
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】2008 年北京奧運會,火炬燃料是環保燃料 C3H8 , 下列說法中正確的是( )
A.利用丙烷的燃燒反應,可以設計成原電池
B.選用丙烷作燃料,除了環保外,還因為它常溫常壓下是液態,便于儲存
C.火炬燃燒時,存在兩種能量轉化形式
D.C3H8燃燒反應中反應物的鍵能和大于生成物鍵能和
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】無水FeCl3在空氣中易潮解,遇水水解,加熱易升華,實驗室可用下列裝置制備。
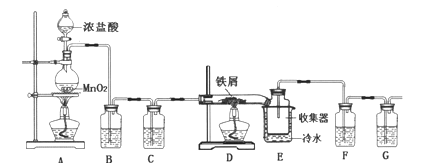
(1)反應開始后,裝置D硬質玻璃管中出現的現象為__________。
(2)裝置F中所盛的試劑為___________。
(3)下列有關該實驗的說法中,不正確的是__________。
A.B裝置的作用是除去HCl,并能減少Cl2的溶解
B.E裝置中冷水的作用是冷卻,使FeCl3冷卻沉積
C.若氯氣不足則會產生FeCl2
D.向燒瓶中加入足量的AgNO3和稀硝酸,可確定生成的MnCl2的質量
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列關于酸堿中和滴定的說法正確的是
A. 強酸滴定弱堿時可用酚酞作指示劑
B. 滴定時向待測液中滴入標準液的速率應先快后慢
C. 滴定過程中,眼睛應始終注視著滴定管的刻度線
D. 若操作無失誤,只需滴定—次即可
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】25 ℃時,用濃度為0.1000 mol·L-1的NaOH溶液滴定25.00 mL濃度均為0.1000 mol·L-1的三種酸HX、HY、HZ,滴定曲線如圖所示。下列說法正確的是:
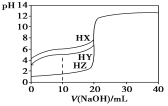
A.在相同溫度下,同濃度的三種酸溶液的導電能力順序:HZ<HY<HX
B.根據滴定曲線,可得Ka(HY)=1×10-5
C.將上述HX、HY溶液等體積混合后,用NaOH溶液滴定至HX恰好完全反應時:
c(X-)>c(Y-)>c(OH-)>c(H+)
D.HY與HZ混合,達到平衡時c(H+)=![]() +c(Z-)+c(OH-)
+c(Z-)+c(OH-)
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com