
【題目】在一定條件下,在一恒容密閉容器中,能表示反應X(g)+Y(g) ![]() 2Z(g)一定達到平衡狀態的是( )
2Z(g)一定達到平衡狀態的是( )
①容器中氣體的密度不再發生變化
②X、Y、Z的濃度不再發生變化
③容器中的壓強不再發生變化
④單位時間內生成n mol Y,同時生成2n mol Z
A.①② B.②④ C.③④ D.①④
 第1卷單元月考期中期末系列答案
第1卷單元月考期中期末系列答案科目:高中化學 來源: 題型:
【題目】回答下列問題:
(1)“高分一號”衛星使用了大功率運載火箭,火箭推進器中裝有還原劑肼(N2H4)和強氧化劑過氧化氫(H2O2),其反應為N2H4(l)+2H2O2(l)=N2(g)+4H2O(g),該反應生成1molH2O(g)釋放出160.4kJ熱量。
①H2O2的電子式為______。
②若反應后,O-H鍵增加了16mol,則反應釋放出的熱量為______kJ。
(2)鎳氫蓄電池具有能量密度大、電壓高、可多次反復充放電等特性,該電池放電時,正極反應式為2NiOOH+2H2O+2e-=2Ni(OH)2+2OH-,負極反應式為H2+2OH-+2e-=2H2O。
①該鎳氫蓄電池放電時的電池總反應為____。
②該電池放電時,OH-向____(填“正極”或“負極”)移動。
③假設該電池放電時有2.408×1024個電子從負極流向正極,則消耗的H2在標準狀況下的體積為____L。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】鋰錳電池的體積小、性能優良,是常用的一次電池。該電池反應原理如圖所示,其中電解質LiClO4,溶于混合有機溶劑中,Li+通過電解質遷移入MnO2晶格中,生成LiMnO2。 回答下列問題:

(1)外電路的電流方向是由________極流向________極(填字母)。
(2)電池正極反應式為___________________________________。
(3)是否可用水代替電池中的混合有機溶劑?________(填“是”或“否”),原因是________________________________________________________________。
(4)MnO2可與KOH和KClO3在高溫下反應,生成K2MnO4,反應的化學方程式為_______________________________________________。K2MnO4在酸性溶液中歧化,生成KMnO4和MnO2的物質的量之比為___________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】如圖是模擬“侯氏制堿法”制取NaHCO3的部分裝置。下列操作正確的是( )

A. a通入CO2,然后b通入NH3,c中放堿石灰
B. b通入NH3,然后a通入CO2,c中放堿石灰
C. a通入NH3,然后b通入CO2,c中放蘸稀硫酸的脫脂棉
D. b通入CO2,然后a通入NH3,c中放蘸稀硫酸的脫脂棉
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下表列出了A~X元素在周期表中的位置,填寫下列空白:
族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0族 |
一 | A | |||||||
二 | L | M | Q | |||||
三 | D | G | J | R | X | |||
四 | E | T |
(1)這些元素中,化學性質最不活潑的是:______(用具體元素符號或化學式等化學用語填空,下同)。
(2)在最高價氧化物對應的水化物中,酸性最強的化合物是________,該化合物與性質表現為兩性氫氧化物的物質反應的離子方程式為__________________________________。
(3)G元素與T元素形成的化合物屬于_______(填“共價”或“離子”)化合物。
(4)D、E、G三種元素按原子半徑由大到小的順序排列__________________。
(5)A元素的單質分別與M元素的單質、R元素的單質反應生成甲、乙,甲、乙常溫下均為氣態,且兩者相遇時可化合成丙。化合物丙的電子式為_____________。
(6)R元素和T元素兩者核電荷數之差是_____。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】石油煉制過程中產生的大量H2S廢氣的處理設計方案如下圖所示,下列說法不合理的是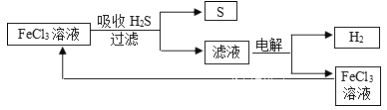
A. 吸收H2S的離子方程式為:2Fe3++H2S=2Fe2++S↓+2H+
B. 電解過程中的陽極可發生的競爭反應主要為:2Cl--2e-=Cl2↑
C. 該工藝流程設計上處理廢氣H2S的同時也獲得產品H2和S
D. 實驗室可用點燃充分燃燒的方法消除H2S污染
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列離子方程式表達正確的是
A. 用惰性電極電解氯化鎂溶液:2Cl+2H2O ![]() Cl2↑+H2↑+2OH-
Cl2↑+H2↑+2OH-
B. 將氯化亞鐵溶液和稀硝酸混合:3Fe2++NO3 -+4H+=3Fe3++NO↑+2H2O
C. 碳酸氫銨溶液與足量氫氧化鈉溶液反應:NH4++ OH-====NH3·H2O
D. NaAlO2 溶液中通入過量 CO2:2AlO2-+ CO2 + 3H2O === 2Al(OH)3↓ +CO32-
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】(1)某同學設計了如下實驗流程:在一個小燒杯里,加入20g Ba(OH)2·8H2O晶體和10gNH4Cl晶體,然后將小燒杯放在事先已滴有3滴~4滴水的玻璃片上,并立即用玻璃棒迅速攪拌。實驗流程示意圖如下,回答下列問題:
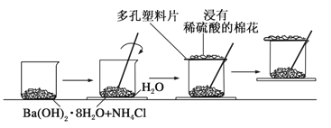
①實驗中玻璃棒的作用是_______。
②浸有稀硫酸的棉花的作用是______。
(2)沼氣是一種廉價能源,農村存在大量的秸稈、雜草等廢棄物,它們經微生物發酵之后,便可產生沼氣,可用來點火做飯。在農村推廣建造沼氣池,不僅能有效地利用____能,還能為農業生產提供優良的肥料。已知:標準狀況下的112.0LCH4氣體完全燃燒,生成CO2和液態水,放出4448kJ的熱量。
①寫出CH4完全燃燒的熱化學方程式為________。
②如果上述反應生成的是水蒸氣,則反應放出的熱量___4448kJ。(填“>”或“<”或“=”)
(3)鋼鐵在潮濕的空氣中生銹主要是由電化學腐蝕造成的,發生腐蝕時鐵和內部的雜質碳及鋼鐵表面的電解質溶液形成原電池。鋼鐵發生吸氧腐蝕時正極的電極反應式________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在一個不傳熱的固定容積的密閉容器中,發生可逆反應mA(g) + nB(g) ![]() pC(g) + qD(g),當m、n、p、q為任意整數時,反應達到平衡的標志是( )
pC(g) + qD(g),當m、n、p、q為任意整數時,反應達到平衡的標志是( )
②體系溫度不再改變
③各組分的濃度不再改變
④各組分的質量分數不再改變
⑤反應速率v(A)∶v(B)∶v(C)∶v(D)=m∶n∶p∶q
⑥單位時間內m mol A斷鍵反應,同時p mol C也斷鍵反應
⑦體系的密度不再變化
A.③④⑤⑥ B.②③④⑥
C.①③④⑤ D.③④⑥⑦
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com