
下列有關電化學知識的描述正確的是( )
A.CaO+H2O=Ca(OH)2,可以放出大量的熱,故可把該反應設計成原電池,把其中的化學能轉化為電能
B.某原電池反應為Cu+2AgNO3=Cu(NO3)2+2Ag,裝置中的鹽橋中可以是裝有含瓊膠的KCl飽和溶液
C.因為鐵的活潑性強于銅,所以將鐵、銅用導線連接后放入濃硝酸中,若能組成原電池,必是鐵作負極,銅作正極
D.理論上說,任何能自發進行的氧化還原反應都可設計成原電池
科目:高中化學 來源:2014年高考化學蘇教版總復習 7-3 化學平衡的移動練習卷(解析版) 題型:填空題
由于溫室效應和資源短缺等問題,如何降低大氣中的CO2含量并加以開發利用,引起了各界的普遍重視。目前工業上有一種方法是用CO2生產燃料甲醇。一定條件下發生反應:CO2(g)+3H2(g) CH3OH(g)+H2O(g),該反應的能量變化如圖所示:
CH3OH(g)+H2O(g),該反應的能量變化如圖所示:
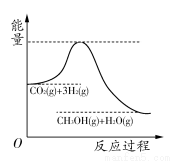
(1)上述反應平衡常數K的表達式為________,溫度降低,平衡常數K________(填“增大”、“不變”或“減小”)。
(2)在體積為2 L的密閉容器中,充入1 mol CO2和3 mol H2,測得CO2的物質的量隨時間變化如下表所示。從反應開始到5 min末,用氫氣濃度變化表示的平均反應速率v(H2)=________。
t/min | 0 | 2 | 5 | 10 | 15 |
n(CO2)/mol | 1 | 0.75 | 0.5 | 0.25 | 0.25 |
(3)在相同溫度容積不變的條件下,能說明該反應已達平衡狀態的是________(填寫序號字母)。
a.n(CO2)∶n(H2)∶n(CH3OH)∶n(H2O)=1∶3∶1∶1
b.容器內壓強保持不變
c.H2的消耗速率與CH3OH的消耗速率之比為3∶1
d.容器內的密度保持不變
(4)下列條件能使上述反應的反應速率增大,且平衡向正反應方向移動的是________(填寫序號字母)。
a.及時分離出CH3OH氣體
b.適當升高溫度
c.保持容器的容積不變,再充入1 mol CO2和3 mol H2
d.選擇高效的催化劑
查看答案和解析>>
科目:高中化學 來源:2014年高考化學蘇教版總復習 7-1 化學反應速率練習卷(解析版) 題型:選擇題
反應①:Fe(s)+CO2(g) FeO(s)+CO(g) ΔH>0;
FeO(s)+CO(g) ΔH>0;
反應②:Fe(s)+H2O(g) FeO(s)+H2(g) ΔH<0。
FeO(s)+H2(g) ΔH<0。
若反應①在溫度T1下進行,反應②在溫度T2下進行,已知T1>T2,且c(CO2)>c(H2O)(其他條件均相同),下面對兩者反應速率大小判斷正確的是( )
A.反應①快 B.反應②快
C.一樣快 D.無法判斷
查看答案和解析>>
科目:高中化學 來源:2014年高考化學蘇教版總復習 6-3 原電池金屬的腐蝕及防護練習卷(解析版) 題型:選擇題
用石墨作電極電解2 mol·L-1的NaCl和1 mol·L-1的MgSO4混合溶液時,下列曲線合理的是( )
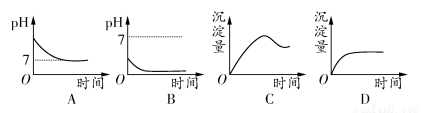
查看答案和解析>>
科目:高中化學 來源:2014年高考化學蘇教版總復習 6-2 原電池、常見的化學電源練習卷(解析版) 題型:填空題
某原電池裝置中盛有濃KOH溶液,若分別向__________(填“正”或“負”,下同)極通入可燃性氣體,向__________極通入O2,則電路中就有電流通過,電流方向由__________極流向__________極,溶液中OH-向__________極移動。試完成下列問題:
| 可燃性氣體 | 正極反應 | 負極反應 | 電池總反應 | pH變化 |
(1) | H2 |
|
|
|
|
(2) | CO |
|
|
| |
(3) | CH4 |
|
|
|
查看答案和解析>>
科目:高中化學 來源:2014年高考化學蘇教版總復習 6-2 原電池、常見的化學電源練習卷(解析版) 題型:選擇題
某新型電池,以NaBH4(B的化合價為+3)和H2O2作原料,該電池可用作深水勘探等無空氣環境電源,其工作原理如圖所示。下列說法正確的是( )
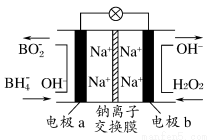
A.電池工作時Na+從b極區移向a極區
B.每消耗3 mol H2O2,轉移3 mol e-
C.b極上的電極反應式為:H2O2+2e-+2H+=2H2O
D.a極上的電極反應式為:BH4—+8OH--8e-=BO2—+6H2O
查看答案和解析>>
科目:高中化學 來源:2014年高考化學蘇教版總復習 6-1 化學反應中的熱效應練習卷(解析版) 題型:選擇題
已知斷開或形成1 mol化學鍵吸收或放出的能量稱為化學鍵的鍵能,如H—H鍵的鍵能為436 kJ·mol-1,N≡N鍵的鍵能為945 kJ·mol-1,N—H鍵的鍵能為391 kJ·mol-1。則下列有關工業合成氨反應的熱化學方程式正確的是 ( )
A.N2(g)+3H2(g)  2NH3(g) ΔH=-93 kJ·mol-1
2NH3(g) ΔH=-93 kJ·mol-1
B.N2(g)+3H2(g)  2NH3(g) ΔH=+1471 kJ·mol-1
2NH3(g) ΔH=+1471 kJ·mol-1
C.N2(g)+3H2(g)  2NH3(g) ΔH=+93 kJ·mol-1
2NH3(g) ΔH=+93 kJ·mol-1
D.N2(g)+3H2(g)  2NH3(g) ΔH=-1471 kJ·mol-1
2NH3(g) ΔH=-1471 kJ·mol-1
查看答案和解析>>
科目:高中化學 來源:2014年高考化學蘇教版總復習 5-2 元素周期律 元素周期表練習卷(解析版) 題型:選擇題
A、B、C、D四種短周期元素,原子序數依次增大而原子半徑依次減小。A、B、D三種元素的最高價氧化物對應的水化物都能相互發生反應。B、C兩原子的最外層電子數之和與D原子的最外層電子數相等。則下列說法中不正確的是( )
A.四種元素都是第三周期的元素
B.工業上常用石灰乳吸收D的單質制取漂白粉
C.A、D兩元素形成的化合物是A元素在自然界中的最主要存在形式
D.C元素的單質稱為硅石,是制作光纜的主要材料
查看答案和解析>>
科目:高中化學 來源:2014年高考化學蘇教版總復習 3-3 含硅礦物與信息材料練習卷(解析版) 題型:選擇題
符合圖中陰影部分的物質是( )

A.Na2CO3 B.Cu2(OH)2CO3 C.NaCl D.NaHCO3
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com