
1.92gCu片與一定量的濃HNO3作用,當收集到NO2和NO氣體共1.12L時(標準狀況),金屬銅恰好全部作用。則:
(1)反應中消耗HNO3 mol,轉移電子 mol
(2)用排水法收集生成的氣體,最后氣體的體積為 L (標準狀況)
(3)向收集到的氣體中通入 mL O2(標準狀況)才能使水剛好充滿整個集氣容器。
⑴0.11 0.06 ⑵0.448 ⑶336
解析試題分析:(1)根據題意知,1.92gCu片與一定量的濃HNO3作用生成硝酸銅、水、NO2和NO。根據銅原子守恒有:n[Cu(NO3)2]= n(Cu),根據氮原子守恒有:n(HNO3)=2n[Cu(NO3)2]+n(NO2+NO),則n(HNO3)=1.92g/64g·mol—1+0.05mol=0.11mol;ne=2nCu=1.92g/64g·mol—1×2=0.06mol;(2)根據題意知,n(NO)+n(NO2)=0.05mol,根據電子守恒有3n(NO)+n(NO2)=0.06mol,解得n(NO)=0.005mol,n(NO2)=0.045mol,利用排水法收集氣體,發生的反應為3NO2+H2O====2HNO3+NO,收集的NO共0.02mol,標準狀況下的體積為0.448L;(3)根據題意知,發生的反應為4NO+3O2+2H2O====4HNO3,n(NO) =0.02mol,則n(O2) =0.015mol,標準狀況下的體積為336mL。
考點:考查硝酸、一氧化氮、二氧化氮的性質,根據化學方程式計算。


 名校練考卷期末沖刺卷系列答案
名校練考卷期末沖刺卷系列答案科目:高中化學 來源: 題型:單選題
為了研究氯水能否和碳酸鈣發生化學反應,某學生設計如下實驗:
實驗一:向盛有飽和氯水的錐形瓶中加入大理石,并充分振蕩,觀察到氯水的黃綠色褪去并同時產生少量氣體。
實驗二:取上述實驗一后錐形瓶中清液,進行如下實驗:
①該清液滴在有色布條上有極強的漂白作用。②該清液中滴加碳酸鈉溶液產生白色沉淀。③該清液中滴加鹽酸可產生大量氣體。④該清液加熱后變渾濁并產生大量氣體。
回答下列問題:
(1)在實驗二中,清液滴在有色布條上有極強的漂白作用說明該清液中含有______________(寫化學式);清液中滴加碳酸鈉溶液產生白色沉淀說明該清液中含有______離子;清液中滴加鹽酸產生的氣體是________;清液加熱后產生渾濁的原因是因為生成了________。
(2)該學生通過上述實驗,寫出氯水和碳酸鈣反應的化學方程式為:
。
查看答案和解析>>
科目:高中化學 來源: 題型:單選題
疊氮酸鈉(NaN3)是無色離子晶體,遇高溫或劇烈震動能發生強烈爆炸,快速分解成鈉單質和氮氣,是汽車安全氣囊中的成分之一。下列有關說法正確的是
| A.NaN3中只含有離子鍵 |
| B.1molNaN3完全分解最多可以產生33.6LN2 |
| C.NaN3快速分解時,NaN3既是氧化劑,又是還原劑 |
| D.常溫下,NaN3化學性質穩定,包裝盒上無需特別說明注意事項 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
在KBr和KI的混合液中通入過量的Cl2,除了水分子外,溶液中主要有 ______分子,若把溶液蒸干得到固體灼燒后還剩下 ____________。
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
(10分)在下圖所示的物質轉化關系中(部分反應條件及產物省略),化合物A由短周期元素組成,B是常見的無色液體,C是能使濕潤的紅色石蕊試紙變藍色的氣體,E是淡黃色粉末,D、F、G均為無色氣體。
完成下列問題:
(1)寫出A的化學式 。
(2)組成F的元素在周期表中位于 周期 族。
(3)B的電子式是 。
(4)反應①的化學方程式: 。
(5)反應②的離子方程式: 。
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
NH3經一系列反應可以得到HNO3,如下圖所示。
(1)I中,NH3和O2在催化劑作用下反應,其化學方程式是_____________________。
(2)II中,2NO(g)+O2 2NO2(g)。在其他條件相同時,分別測得NO的平衡轉化率在不同壓強(P1、P2)下溫度變化的曲線(如右圖)。
2NO2(g)。在其他條件相同時,分別測得NO的平衡轉化率在不同壓強(P1、P2)下溫度變化的曲線(如右圖)。
①比較P1、P2的大小關系:________________。
②隨溫度升高,該反應平衡常數變化的趨勢是________________。
(3)III中,降低溫度,將NO2(g)轉化為N2O4(l),再制備濃硝酸。
①已知:2NO2(g) N2O4(g)△H1
N2O4(g)△H1
2NO2(g) N2O4(l)△H2
N2O4(l)△H2
下列能量變化示意圖中,正確的是(選填字母)_______________。
②N2O4與O2、H2O化合的化學方程式是_________________。
(4)IV中,電解NO制備 NH4NO3,其工作原理如右圖所示,為使電解產物全部轉化為NH4NO3,需補充物質A,A是_____________,說明理由:________________。
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
(17分)Na2SO3固體在空氣中久置容易變質 。
(I)Na2SO3固體在空氣中變質的主要原因,用化學方程式表示為 。
(II)為探究Na2SO3樣品的變質情況,現提出以下假設:
假設1:Na2SO3樣品完全變質; 假設2:Na2SO3樣品完全沒有變質;假設3: 。
補充完成以下實驗過程及現象和結論,完成探究。
| 實驗操作 | 現象和結論 |
| 步驟1:取少許樣品于試管中,加入適量蒸餾水充分溶解,再滴加H2SO4酸化的KMnO4溶液; | 現象:若KMnO4溶液的紫紅色褪為無色 ①結論:樣品中有 離子,假設1不成立。 ②褪色的離子方程式為: 。 |
| 步驟2:另取少許樣品于試管中,加入適量蒸餾水充分溶解,再滴加稀HCl,使溶液呈酸性,再滴加適量BaCl2溶液; | ③現象:若 ; 結論:假設2成立。 |
| …… | …… |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
(12分)【化學—化學與技術】
硫酸是工業生產中最為重要的產品之一,在化學工業的很多領域都要用到濃硫酸。
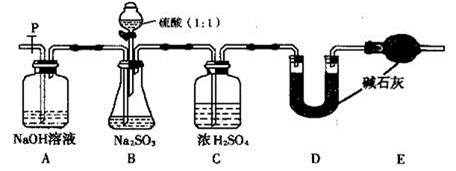
(1)在硫酸工業生產中,我國采用黃鐵礦為原料生產SO2,反應的化學方程式為 ,該反應在 中進行(填設備名稱)。
(2)為了有利于SO2轉化為SO3,且能充分利用熱能,采用了多層催化劑且有熱交換器的 (填設備名稱)中進行反應。在如圖所示的裝置中,C處流出的氣體有 ;SO3進入 (填設備名稱)用____ 吸收,得到濃硫酸或發煙硫酸。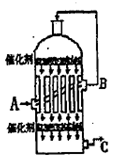
(3)實驗測得SO2反應生成SO3的轉化率與溫度、壓強有關,請根據下表信息,結合工業生產實際,選擇最合適的生產條件是 。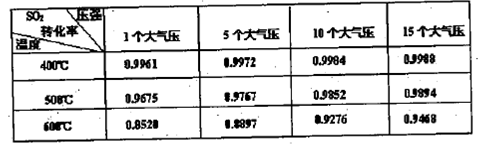
(4)吸收塔排出的尾氣中SO2的含量如果超過500 L/L,就要加以處理后才能排出,處理方法之一是用氨水洗滌煙氣脫硫,用方程式表示氨水洗滌吸收塔排除的尾氣的化學方程式
L/L,就要加以處理后才能排出,處理方法之一是用氨水洗滌煙氣脫硫,用方程式表示氨水洗滌吸收塔排除的尾氣的化學方程式
。
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
現有四個無標簽的試劑瓶,分別盛有硫酸、BaCl2溶液、鹽酸和不知名稱的某正鹽溶液M,將四種試劑分別標為A、B、C、D,取少量試劑分別進行實驗得到如表格所示關系(其中無色氣體能使澄清石灰水變渾濁,M溶液進行焰色反應為黃色)。
| | A | B | C | D |
| A | | 白色沉淀X | | 白色沉淀Y |
| B | 白色沉淀X | | | 無色氣體 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com