
【題目】某實驗小組同學進行如下實驗,以檢驗化學反應中的能量變化。
(1)實驗中發現,反應后①中的溫度升高;②中的溫度降低。由此判斷鋁條與鹽酸的反應是__熱反應,Ba(OH)28H2O與NH4Cl反應時,需要將固體研細其目的是_。反應過程__(填“①”或“②”)的能量變化可用圖表示。

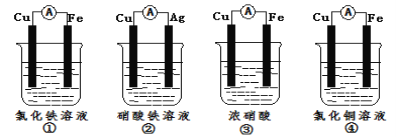
(2)為了驗證Fe3+與Cu2+氧化性強弱,下列裝置能達到實驗目的是_(填序號)。
(3)將CH4設計成燃料電池,其利用率更高,裝置如圖所示(a、b為多孔碳棒)其中_(填A或B)處電極入口通甲烷,當消耗標況下甲烷33.6L時,假設能量轉化率為90%,則導線中轉移電子的物質的量為__mol。

(4)如圖是某化學興趣小組探究不同條件下化學能轉變為電能的裝置。請回答下列問題:

①當電極c為Al、電極d為Cu、電解質溶液為稀硫酸時,寫出該原電池正極的電極反應式為__。
②當電極c為Al、電極d為Mg、電解質溶液為氫氧化鈉溶液時,該原電池的負極反應式為__。
【答案】放 擴大接觸面積,提高反應速率 ① ② A 10.8 2H++2e-═H2↑ Al+4OH-﹣3e-=AlO2-+2H2O
【解析】
(1)反應①溫度升高,說明是放熱反應;反應②將固體研細,可以增大接觸面積,提高反應速率;示意圖中的反應物的總能量高于生成物的總能量,為放熱反應的能量變化圖,與①吻合;故答案為:放;擴大接觸面積,提高反應速率;①;
(2)①的總反應為:Fe+2Fe3+=3Fe2+,Fe3+的氧化性強于Fe2+,不符合,①錯誤;
②的總反應為:Cu+2Fe3+=Cu2++2Fe2+,Fe3+的氧化性強于Cu2+,符合,②正確;
③的總反應為:Cu+4H++2NO3-=Cu2++2H2O+2NO2↑,NO3-的氧化性強于Cu2+,不符合,③錯誤;
④的總反應為:Fe+Cu2+=Cu+Fe2+,Cu2+的氧化性強于Fe2+,不符合,④錯誤;
答案為:②;
(3)根據示意圖,a極失電子,則a極為負極,b極為正極,燃料通入燃料電池的負極,所以,A處電極入口通甲烷,負極的反應式為:CH4+10OH--8e-=CO32-+7H2O, ,n=10.8mol,故答案為:A;10.8;
,n=10.8mol,故答案為:A;10.8;
(4)①電極c為Al、電極d為Cu、電解質溶液為稀硫酸時,構成Al-Cu-H2SO4原電池,Cu作正極,H+在正極得電子生成H2,電極反應式為:2H++2e-=H2↑,故答案為:2H++2e-=H2↑;
②電極c為Al、電極d為Mg,電解質溶液為氫氧化鈉溶液時,構成Al-Mg-NaOH原電池,Al作負極,電極反應式為:Al+4OH-﹣3e-=AlO2-+2H2O,故答案為:Al+4OH-﹣3e-=AlO2-+2H2O。


科目:高中化學 來源: 題型:
【題目】某溫度下,在一個2L的密閉容器中,加入4 mol A和2 mol B進行如下反應:3A(g)+2B(g)![]() 4C(s)+D(g),反應2 min后達到平衡,測得生成1.6 mol C,下列說法正確的是( )
4C(s)+D(g),反應2 min后達到平衡,測得生成1.6 mol C,下列說法正確的是( )
A. 前2 min,D的平均反應速率為0.2 mol/(L·min)
B. 此時,B的平衡轉化率是40%
C. 增大該體系的壓強,平衡不移動
D. 增加B,平衡向右移動,B的平衡轉化率增大
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】無水氯化鋁在生產、生活中應用廣泛。
(1)氯化鋁水溶液呈_____性,原因是(用離子方程式表示)________;把AlCl3溶液蒸干,灼燒,最后得到的主要固體產物是_______。
(2)工業上用鋁土礦(主要成分為Al2O3,含有Fe2O3、SiO2等雜質)制取無水氯化鋁的一種工藝流程示意如下:

已知:
物質 | SiCl4 | AlCl3 | FeCl3 | FeCl2 |
沸點/℃ | 57.6 | 180(升華) | 300(升華) | 1023 |
①步驟Ⅰ中焙燒使固體水分揮發、氣孔數目增多,其作用是___________(只要求寫出一種)。
②步驟Ⅱ中若不通入氯氣和氧氣,則反應生成相對原子質量比硅大的單質是_____。
③ 已知:
Al2O3(s)+3C(s)=2Al(s)+3CO(g) ΔH1=+1344.1kJ ·mol-1
2AlCl3(g)=2Al(s)+3Cl2(g) ΔH2=+1169.2kJ ·mol-1
由Al2O3、C和Cl2反應生成AlCl3的熱化學方程式為______________。
④步驟Ⅲ經冷卻至室溫后,氣體用足量的NaOH冷溶液吸收,生成的鹽主要有3種,其化學式分別為_______、 _______ 、 _________。
⑤結合流程及相關數據分析,步驟Ⅴ中加入鋁粉的目的是___________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】工業合成氨反應:N2+3H2![]() 2NH3是一個放熱的可逆反應,反應條件是高溫、高壓,并且需要合適的催化劑。已知形成1 mol H-H鍵、1 mol N-H鍵、1 mol N≡N鍵放出能量分別為436 kJ、391 kJ、946 kJ。則:
2NH3是一個放熱的可逆反應,反應條件是高溫、高壓,并且需要合適的催化劑。已知形成1 mol H-H鍵、1 mol N-H鍵、1 mol N≡N鍵放出能量分別為436 kJ、391 kJ、946 kJ。則:
(1)若1 mol N2完全反應生成NH3可________(填“吸收”或“放出”)熱量________kJ。
(2)如果將1 mol N2和3 mol H2混合,使其充分反應,放出的熱量總小于上述數值,其原因是________________________。
(3)實驗室模擬工業合成氨時,在容積為2 L的密閉容器內,反應經過10 min后,生成10 mol NH3,則用N2表示的化學反應速率為________mol·L-1·min-1。
(4)一定條件下,當合成氨的反應達到化學平衡時,下列說法正確的是________。
a.正反應速率和逆反應速率相等
b.正反應速率最大,逆反應速率為0
c.N2的轉化率達到最大值
d.N2和H2的濃度相等
e.N2、H2和NH3的體積分數相等
f.反應達到最大限度
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】一定溫度下,有![]() 鹽酸;
鹽酸;![]() 硫酸;
硫酸;![]() 醋酸三種酸的稀溶液
醋酸三種酸的稀溶液![]() 用a、b、c、
用a、b、c、![]() 、
、![]() 、
、![]() 號填寫
號填寫![]()
![]() 當其物質的量濃度相同時,
當其物質的量濃度相同時,![]() 由大到小的順序是____________,
由大到小的順序是____________,
![]() 同體積同物質的量濃度的三種酸,中和NaOH能力由大到小的順序是____________,
同體積同物質的量濃度的三種酸,中和NaOH能力由大到小的順序是____________,
![]() 當其
當其![]() 相同時,物質的量濃度由大到小的順序為____________,
相同時,物質的量濃度由大到小的順序為____________,
![]() 當
當![]() 相同、體積相同時,同時加入形狀、質量、密度相同的鋅,若產生相同體積的氫氣
相同、體積相同時,同時加入形狀、質量、密度相同的鋅,若產生相同體積的氫氣![]() 相同狀況
相同狀況![]() ,則開始時反應速率的大小關系是____________.
,則開始時反應速率的大小關系是____________.
![]() 將
將![]() 相同的三種酸均加水稀釋至原來的10倍,
相同的三種酸均加水稀釋至原來的10倍,![]() 由大到小的順序為_____________.
由大到小的順序為_____________.
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】有關物質的量的計算:
(1)2 mol尿素[CO(NH2)2]含__個H原子,所含氧原子跟_____g H2O所含氧原子個數相等。
(2)2.4g 鎂中含______mol電子,在與足量鹽酸反應中產生標準狀況下的氫氣體積為 ______L。
(3)30.9gNaR含有Na+ 0.3mol,則NaR的摩爾質量為_____。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】工業上用CO生產燃料甲醇。一定溫度和容積條件下發生反應:CO(g)+2H2(g)![]() CH3OH(g)。圖2表示反應中的能量變化;圖1表示一定溫度下,在體積為1L的密閉容器中加入2mol H2和一定量的CO后,CO和CH3OH(g)的濃度隨時間變化。
CH3OH(g)。圖2表示反應中的能量變化;圖1表示一定溫度下,在體積為1L的密閉容器中加入2mol H2和一定量的CO后,CO和CH3OH(g)的濃度隨時間變化。

請回答下列問題:
(1)在“圖2”中,曲線__(填“a”或“b”)表示使用了催化劑;沒有使用催化劑時,在該溫度和壓強條件下反應CO(g)+2H2(g) CH3OH(g)的△H=_________。
(2)從反應開始到建立平衡,v(CO)=_______;達到平衡時,c(H2)=_____,該溫度下CO(g)+2H2(g)![]() CH3OH(g)的化學平衡常數為_____________。達到平衡后若保持其它條件不變,將容器體積壓縮為0.5L,則平衡__________移動(填“正向”、“逆向”或“不”)。
CH3OH(g)的化學平衡常數為_____________。達到平衡后若保持其它條件不變,將容器體積壓縮為0.5L,則平衡__________移動(填“正向”、“逆向”或“不”)。
(3)恒容條件下,下列措施中能使n(CH3OH)/n(CO)增大的有___________.
a.升高溫度 b.充入He氣 c.再充入2molH2 d.使用催化劑.
(4)已知CH3OH(g)+3/2O2(g)=CO2(g)+2H2O(g);ΔH=-193kJ/mol。又知H2O(l)= H2O(g);ΔH=+44 kJ/mol,請寫出32g的CH3OH(g)完全燃燒生成液態水的熱化學方程式________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】緩釋布洛芬是常用的解熱鎮痛藥物,其一種合成路線如下:

已知:① 
② R1COOR2 + R3OH ![]() R1COOR3 + R2OH
R1COOR3 + R2OH
(1)按照官能團分類,A所屬的類別是______。
(2)反應①的化學方程式是______。
(3)試劑X的結構簡式是______。
(4)F→G的反應類型是______。
(5)H的結構簡式是______。
(6)反應②的化學方程式是______。
(7)緩釋布洛芬能緩慢水解釋放出布洛芬,請將下列方程式補充完整。
 + 2n H2O
+ 2n H2O![]() ______
______
(8)以丙烯為起始原料制備丙酮酸甲酯(![]() )的合成路線如下,請補充完整(無機試劑任選)。_____
)的合成路線如下,請補充完整(無機試劑任選)。_____
![]()
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】醋酸溶液中存在電離平衡CH3COOH![]() H++CH3COO-,不正確的是( )
H++CH3COO-,不正確的是( )
A. 醋酸溶液中離子濃度的關系滿足:c(H+)=c(OH-)+c(CH3COO-)
B. 常溫下0.10mol/L的CH3COOH溶液中加水稀釋,溶液中c(OH-)減小
C. CH3COOH溶液中加少量的CH3COONa固體,平衡逆向移動
D. 常溫下pH=2的CH3COOH溶液與pH=12的NaOH溶液等體積混合后,溶液的pH<7
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com