
【題目】在下列平衡體系中,保持溫度一定時,改變某一物質的濃度,混合氣體的顏色會改變;改變壓強時,顏色也會改變,但平衡并不移動,這個反應是( )
A. 2NO+O2![]() 2NO2 B. Br2(g)+H2
2NO2 B. Br2(g)+H2 ![]() 2HBr
2HBr
C. N2O4 ![]() 2NO2 D. 6NO+4NH3
2NO2 D. 6NO+4NH3 ![]() 5N2+3H2O
5N2+3H2O
科目:高中化學 來源: 題型:
【題目】下列儀器中,可直接用酒精燈加熱的是( )
①燒杯;②坩堝;③錐形瓶;④蒸發皿;⑤試管;⑥圓底燒瓶;⑦容量瓶
A. ②④⑤ B. ①②⑤⑥ C. ②④⑥⑦ D. ①②③⑤
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】近年來甲醇用途日益廣泛,越來越引起商家的關注,工業上甲醇的合成途徑多種多樣。現有實驗室中模擬甲醇合成反應,在2L密閉容器內,400℃時反應:CO(g)+2H2(g)![]() CH3OH(g) △H<0,體系中n(CO)隨時間的變化如下表:
CH3OH(g) △H<0,體系中n(CO)隨時間的變化如下表:
時間(s) | 0 | 1 | 2 | 3 | 5 |
n(CO)(mol) | 0.020 | 0.011 | 0.008 | 0.007 | 0.007 |
(1)圖中表示CH3OH的變化的曲線是_______。

(2)用H2表示從0~2s內該反應的平均速率v(H2)=___________________。
(3)該反應達到最大限度時CO的轉化率為___________。
(提示:轉化率=![]() ×100%)
×100%)
(4)能說明該反應已達到平衡狀態的是______。
a. CO與H2的濃度保持不變 b. 容器內密度保持不變
c. 容器內壓強保持不變 d. 每消耗1molCH3OH的同時有2mol H–H形成
(5)CH3OH與O2的反應可將化學能轉化為電能,其工作原理如下圖所示,圖中CH3OH從______(填A或B)通入。
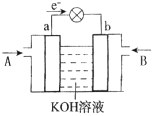
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某溫度下, 2SO2+O2![]() 2SO3(正反應放熱)已達平衡,保持其它條件不變,只改變其中一個條件,v(正)、v(逆)的變化如圖所示。下列判斷正確的是 ( )
2SO3(正反應放熱)已達平衡,保持其它條件不變,只改變其中一個條件,v(正)、v(逆)的變化如圖所示。下列判斷正確的是 ( )
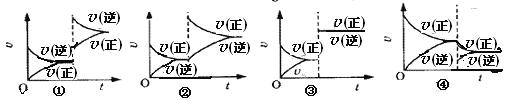
A. ①圖可能是由于加壓、使容器體積減小引起的
B. ②圖可能是升高溫度引起的
C. ③圖可能是加壓、縮小容器體積引起的
D. ④圖是只減少了SO3的濃度引起的
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】化學與環境密切相關,下列說法正確的是( )
A.CO2屬于大氣污染物B.酸雨是pH小于7的雨水
C.將電器垃圾深埋處理,可減少重金屬污染D.大霧是一種膠體,能發生丁達爾效應
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】Ⅰ、在298K、100kPa時,在1L水中可溶解0.09mol氯氣,實驗測得溶于水的Cl2約有三分之一與水反應。請回答下列問題:
(1)列式近似計算該反應在298K的平衡常數___________。
(2)如果增大氯氣的壓強,平衡將向______________移動。
Ⅱ、甲酸甲酯水解反應方程式為:HCOOCH3(1)+H2O(1)![]() HCOOH(l)+CH3OH(1) △H>0
HCOOH(l)+CH3OH(1) △H>0
某小組通過試驗研究該反應(反應過程中體積變化忽略不計)。反應體系中各組分的起始量如下表:
組分 | HCOOCH3 | H2O | HCOOH | CH3OH |
物質的量/mol | 1.00 | 1.99 | 0.01 | 0.52 |
甲酸甲酯轉化率在溫度T1下隨反應時間(t)的變化如下圖:

(3)請計算15~20min范圍內甲酸甲酯的減少量為____________________mol
(4)根據上述條件,計算不同時間范圍內甲酸甲酯的平均反應速率,結果見下表:
反應時間 / min | 0~5 | 10~15 | 20~25 | 30~35 | 40~45 | 50~55 | 60~65 |
平均反應速率 /(10-3mol·min-1) | 1.9 | 7.4 | 7.8 | 4.4 | 1.6 | 0.8 | 0.0 |
依據以上數據,出該反應的反應速率在不同階段的變化規律:________,其原因是:_________ 。
(5)其他條件不變,僅改變溫度為T2(T2大于T1),在答題卡框圖中畫出溫度T2下甲酸甲酯轉化率隨反應時間變化的預期結果示意圖。__________
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在體積為2L容器中放入2molA和2molB,一定條件下發生反應:aA(s)+bB(g)![]() dD(g)+eE(g)(放熱反應),5分鐘后達到平衡,平衡時B的轉化率為50%,
dD(g)+eE(g)(放熱反應),5分鐘后達到平衡,平衡時B的轉化率為50%,
(1)若從反應開始,甲同學控制恒溫恒容,乙同學控制恒溫恒壓,且b >d+e ,則平衡時B的轉化率甲____乙(填“大于”、“小于”或“等于”)
(2)若從反應開始,甲同學控制恒溫恒容,乙同學控制恒容絕熱,則平衡時B的轉化率:甲___乙。(填“大于”、“小于”或“等于”)
(3)若控制恒溫恒容,反應達到平衡后,混合氣體的密度比反應未達平衡前 _____(填“增大”、“不變”或“減小”)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】mA(氣) + nB(氣) ![]() pC(氣) + qD(氣)的 C % 與時間t有如圖關系
pC(氣) + qD(氣)的 C % 與時間t有如圖關系
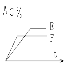
(1)若E、F表示兩種溫度,則 E____F ( 填 > 、< 或 = ),正反應____ 熱
(2)若E、F表示兩種壓強,則 m + n_____p + q ( 填 > 、< 或 = )
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】以H2、O2、熔融鹽Na2CO3組成燃料電池,采用電解法制備Fe(OH)2,裝置如圖所示,其中電解池兩極材料分別為鐵和石墨,通電一段時間后,右側玻璃管中產生大量的白色沉淀。則下列說法正確的是

A. 石墨電極Ⅱ處的電極反應式為O2+4e-===2O2-
B. X是鐵電極
C. 電解池中的電解液為蒸餾水
D. 若將電池兩極所通氣體互換,X、Y兩極材料也互換,實驗方案更合理
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com