
【題目】一定條件下,可逆反應的平衡常數可以用平衡濃度計算,也可以用平衡分壓代替平衡濃度計算,分壓=總壓×物質的量分數.在恒溫恒壓條件下,總壓不變,用平衡分壓計算平衡常數更方便.下列說法不正確的是( )
A.對于C2H4 (g)+H2O(g)?C2H5OH(g),在一定條件下達到平衡狀態時,體系的總壓強為P,其中C2H4(g)、H2O(g)、C2H5OH(g)均為2 mol,則用分壓表示的平衡常數Kp= ![]()
B.恒溫恒壓下,在一容積可變的容器中,N2(g)+3H2(g)?2NH3(g)達到平衡狀態時,N2、H2、NH3各1mol,若此時再充入3mol N2 , 則平衡正向移動
C.恒溫恒壓下,在一容積可變的容器中,反應2A(g)+B(g)?2C(g)達到平衡時,A、B和 C的物質的量分別為4mol、2mol和4mol,若此時A、B和C均減少1 mol,平衡逆向移動
D.對于一定條件下的某一可逆反應,用平衡濃度表示的平衡常數和用平衡分壓表示的平衡常數,其數值不同,但意義相同,都只與溫度有關
【答案】B
【解析】解:A.體系的總壓強為P,其中C2H4(g)、H2O(g)、C2H5OH(g)均為l mol,分壓P(C2H5OH)=P× ![]() =
= ![]() ,P(C2H4)=P×
,P(C2H4)=P× ![]() =
= ![]() ,P(H2O)=P×
,P(H2O)=P× ![]() =
= ![]() ,平衡常數K=
,平衡常數K= ![]() =
= ![]() ,故A正確;
,故A正確;
B.恒溫恒壓下,在一容積可變的容器中,N2(g)+3H2(g)2NH3(g)達到平衡狀態時,N2、H2、NH3各1mol,設平衡時容器體積為1L,該溫度下平衡常數K= ![]() =1,若此時再充入3molN2 , 恒溫恒壓下體積之比等于氣體物質的量之比,則容器體積=1L×
=1,若此時再充入3molN2 , 恒溫恒壓下體積之比等于氣體物質的量之比,則容器體積=1L× ![]() =2L,Qc=
=2L,Qc= ![]() =1=K,平衡不動,故B錯誤;
=1=K,平衡不動,故B錯誤;
C.在容積可變的情況下,從對平衡混合物中三者的物質的量對各物質的量的濃度影響角度思考.在“均減半”或“均加培”時,相當于A、B、C三物質的濃度都沒有改變,原平衡時A、B和C的物質的量之比為2:1:2,“均減少1mol”時相當于相當于在原來的基礎上減少了B,平衡逆向移動,故C正確;
D.平衡常數隨溫度變化,平衡濃度計算和平衡分壓計算表達意義相同,對于一定條件下的某一可逆反應,用平衡濃度表示的甲衡常數和用平衡分壓表示的平衡常數,其數值不同,但意義相同,都只與溫度有關,故D正確;
故選B.
【考點精析】解答此題的關鍵在于理解化學平衡常數的含義的相關知識,掌握指在一定條件下的可逆反應里,正反應和逆反應的速率相等,反應混合物中各組分的濃度不變的狀態,以及對化學平衡的計算的理解,了解反應物轉化率=轉化濃度÷起始濃度×100%=轉化物質的量÷起始物質的量×100%;產品的產率=實際生成產物的物質的量÷理論上可得到產物的物質的量×100%.


 海淀黃岡名師導航系列答案
海淀黃岡名師導航系列答案 普通高中同步練習冊系列答案
普通高中同步練習冊系列答案 優翼小幫手同步口算系列答案
優翼小幫手同步口算系列答案科目:高中化學 來源: 題型:
【題目】一定條件下,可逆反應的平衡常數可以用平衡濃度計算,也可以用平衡分壓代替平衡濃度計算,分壓=總壓×物質的量分數.在恒溫恒壓條件下,總壓不變,用平衡分壓計算平衡常數更方便.下列說法不正確的是( )
A.對于C2H4 (g)+H2O(g)?C2H5OH(g),在一定條件下達到平衡狀態時,體系的總壓強為P,其中C2H4(g)、H2O(g)、C2H5OH(g)均為2 mol,則用分壓表示的平衡常數Kp= ![]()
B.恒溫恒壓下,在一容積可變的容器中,N2(g)+3H2(g)?2NH3(g)達到平衡狀態時,N2、H2、NH3各1mol,若此時再充入3mol N2 , 則平衡正向移動
C.恒溫恒壓下,在一容積可變的容器中,反應2A(g)+B(g)?2C(g)達到平衡時,A、B和 C的物質的量分別為4mol、2mol和4mol,若此時A、B和C均減少1 mol,平衡逆向移動
D.對于一定條件下的某一可逆反應,用平衡濃度表示的平衡常數和用平衡分壓表示的平衡常數,其數值不同,但意義相同,都只與溫度有關
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】(1)合理膳食、均衡營養是保證人體健康和生活質量的重要途徑。
①人體必需的元素攝入不足會影響人體的正常生理活動。下列做法不能達到目的的是______。
a.補碘——食用加碘鹽 b.補鐵——使用鐵強化醬油 c.補鈣——服用葡萄糖
②人體內有8種氨基酸必需通過食物攝入,某品牌餅干含有的下列物質中能轉化為氨基酸的是______。
a.纖維素 b.蛋白質 c.油脂
③人類歷史上最重要的抗生素是______。
a.青霉素 b.維生素 c.胡蘿卜素
(2)構建人與自然的和諧、營造安全的生態環境已成為全人類的共識。
①如圖,向兩只250mL的錐形瓶中分別充入CO2和空氣,用白熾燈泡照射一段時間后,其中a瓶中溫度計讀數稍低,則盛放CO2的錐形瓶為______(填“a”或“b”)。
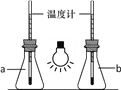
②為防止白色污染,廢舊的塑料需投入到貼有如圖標志的垃圾桶內,該標志表示的是______。

③廢水中鉈(Tl)具有高毒性,治理時常加入NaClO溶液,將Tl+轉變為Tl3+,NaClO作_____(填“氧化劑”或“還原劑”),同時加入適量氨水,將Tl3+轉變為難溶物Tl(OH)3,寫出生成Tl(OH)3的離子方程式______。
(3)材料是人類社會發展的物質基礎,材料科學的發展離不開化學。
①黏土是陶瓷的生產原料,其中江蘇宜興的高嶺土是含有雜質較少的高品質黏土,其主要組成可表示為Al2Si2Ox(OH)4,則x=______。
②2016年奧運會在巴西舉行,場館的建設需大量的建筑材料。其中生產水泥、玻璃共同的原料是______(填名稱),場館內的座椅通常用高密度聚乙烯(HDPE)為原料制得,聚乙烯屬于______塑料(填“熱固性”或“熱塑性”)。
③滬通鐵路建設正在積極推進,其中如何防止鐵軌的腐蝕是工程技術人員攻克的難題之一。鐵在發生電化學腐蝕時的負極反應方程式為______。
④工業上常用SiCl4與O2在高溫條件下通過置換反應制得SiO2,并于2000℃下拉成光纖細絲。該反應的化學方程式為______。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知N2(g)+3H2(g) ![]() 2NH3(g),現向一密閉容器中充入1molN2和3molH2 , 在高溫、高壓和催化劑存在條件下發生反應.下列有關說法正確的是( )
2NH3(g),現向一密閉容器中充入1molN2和3molH2 , 在高溫、高壓和催化劑存在條件下發生反應.下列有關說法正確的是( )
A.最終可以生成2molNH3
B.達到化學平衡狀態時,正反應和逆反應的速率都為0
C.達到化學平衡狀態時,容器中N2、H2和NH3的物質的量之比為1:3:2
D.達到化學平衡狀態時,N2、H2和NH3的物質的量濃度不再變化
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列有關說法正確的是( )
A. 共價鍵一定只存在于共價化合物中
B. CH3CH2CH3光照下與氯氣反應,只生成1種一氯代烴
C. 苯在濃硫酸催化下與濃硝酸的反應是取代反應
D. 石油裂解和裂化的目的相同
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知用硫酸酸化的草酸(H2C2O4)溶液能與KMnO4溶液反應.某化學小組研究發現,少量MnSO4可對該反應起催化作用.為進一步研究有關因素對該反應速率的影響,探究如下:
(1)常溫下,探究不同的初始pH和草酸溶液濃度對反應速率的影響,設計如下實驗,則A= , C= , E=
實驗編號 | 溫度 | 初始pH | 0.1mol/L草酸溶液體積/mL | 0.01mol/LKMnO4 | 蒸餾水體積/mL | 待測數據(混合液褪色時間/s) |
① | 常溫 | 1 | 20 | 50 | 30 | t1 |
② | 常溫 | A | B | C | 30 | t2 |
③ | 常溫 | 2 | 40 | D | E | t3 |
(2)該反應的離子方程式 .
(3)若t1<t2 , 則根據實驗①和②得到的結論是 .
(4)小組同學發現每組實驗反應速率隨時間的變化總是如圖,其中t1~t2時間內速率變快的主要原因可能是: 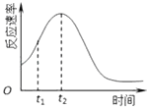
①;②
(5)化學小組用滴定法測定KMnO4溶液物質的量濃度:取ag草酸晶體(H2C2O42H2O,摩爾質量126g/mol)溶于水配成250mL溶液,取25.00mL溶液置于錐形瓶中,加入適量稀H2SO4酸化,再用KMnO4溶液滴定至終點,重復滴定三次,平均消耗KMnO4溶液VmL.滴定到達終點的現象是:;實驗中所需的定量儀器有(填儀器名稱).該KMnO4溶液的物質的量濃度為mol/L.
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】對于反應2SO2(g)+O2(g)2SO3(g) 最終能增大反應速率的措施是( )
A.降低體系溫度
B.增大容器容積
C.減小O2的濃度
D.升高體系溫度
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】煤氣化和液化是現代能源工業中重點考慮的能源綜合利用方案。最常見的氣化方法為用煤生產水煤氣,而當前比較流行的液化方法為用煤生產CH3OH。
(1)已知:CO2(g)+3H2(g)===CH3OH(g)+H2O(g) ΔH1
2CO(g)+O2(g)===2CO2(g) ΔH2
2H2(g)+O2(g)===2H2O(g) ΔH3
則反應CO(g)+2H2(g)===CH3OH(g)的ΔH=______。
(2)如圖是該反應在不同溫度下CO的轉化率隨時間變化的曲線。

①T1和T2溫度下的平衡常數大小關系是K1________K2(填“>”、“<”或“=”)。
②由CO合成甲醇時,CO在250 ℃、300 ℃、350 ℃下達到平衡時轉化率與壓強的關系曲線如下圖所示,則曲線c所表示的溫度為________ ℃。實際生產條件控制在250 ℃、1.3×104 kPa左右,選擇此壓強的理由是____________。

③以下有關該反應的說法正確的是________(填序號)。
A.恒溫、恒容條件下,若容器內的壓強不再發生變化,則可逆反應達到平衡
B.一定條件下,H2的消耗速率是CO的消耗速率的2倍時,可逆反應達到平衡
C.使用合適的催化劑能縮短達到平衡的時間并提高CH3OH的產率
D.某溫度下,將2 mol CO和6 mol H2充入2 L密閉容器中,充分反應,達到平衡后,測得c(CO)=0.2 mol·L-1,則CO的轉化率為80%
(3)一定溫度下,向2 L固定體積的密閉容器中加入1 mol CH3OH(g),發生反應:CH3OH(g) ![]() CO(g)+2H2(g),H2的物質的量隨時間變化的曲線如圖所示。
CO(g)+2H2(g),H2的物質的量隨時間變化的曲線如圖所示。

0~2 min內的平均反應速率v(CH3OH)=__________。該溫度下,反應CO(g)+2H2(g) ![]() CH3OH(g)的平衡常數K=__________。相同溫度下,在一個恒容容器中加入一定量的CO(g)和H2發生:CO(g)+2H2(g)
CH3OH(g)的平衡常數K=__________。相同溫度下,在一個恒容容器中加入一定量的CO(g)和H2發生:CO(g)+2H2(g) ![]() CH3OH(g)的反應,某時刻測得體系中各物質的量濃度如下:C(CO)=0.25 mol·L-1,C(H2)=1.0 mol·L-1,C(CH3OH)=0.75 mol·L-1,則此時該反應_____進行(填“向正反應方向”“向逆反應方向”或“處于平衡狀態”)。
CH3OH(g)的反應,某時刻測得體系中各物質的量濃度如下:C(CO)=0.25 mol·L-1,C(H2)=1.0 mol·L-1,C(CH3OH)=0.75 mol·L-1,則此時該反應_____進行(填“向正反應方向”“向逆反應方向”或“處于平衡狀態”)。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com