
【題目】將少量的鋁投入過量的氫氧化鈉溶液中充分反應,下列有關所得混合溶液的敘述正確的是( ) 
A.該溶液中,Ag+、K+、NH4+、SO42﹣可以大量共存
B.該溶液中,Na+、OH﹣、NO3﹣、CO32﹣不能大量共存
C.向該溶液中逐滴加入AlCl3溶液,生成沉淀與加入AlCl3溶液關系如圖
D.向該溶液中逐滴加入稀鹽酸,生成沉淀與加入稀鹽酸關系如圖
【答案】D
【解析】解:將少量的鋁投入過量的氫氧化鈉溶液中充分反應,反應后溶液中存在AlO2﹣、OH﹣等,溶液呈堿性; A.堿性條件下Ag+、NH4+不能大量共存,分別生成沉淀、氨氣等,故A錯誤;
B.堿性條件下,離子之間不發生任何反應,可大量共存,故B錯誤;
C.溶液呈堿性,向該溶液中逐滴加入AlCl3溶液,開始生成偏鋁酸鈉,后生成氫氧化鋁沉淀,繼續加入氯化鋁,沉淀不溶解,故C錯誤;
D.向該溶液中逐滴加入稀鹽酸,先發生中和反應,后生成氫氧化鋁沉淀,最后氫氧化鋁溶解,圖象符合,故D正確.
故選D.
【考點精析】通過靈活運用鋁的化學性質,掌握很快與O2反應,形成致密氧化膜,抗腐蝕性比鎂強;在純氧中或高溫下可燃燒;與沸水只有微弱反應即可以解答此題.


 手拉手全優練考卷系列答案
手拉手全優練考卷系列答案科目:高中化學 來源: 題型:
【題目】某研究小組為探究影響過氧化氫分解的因素,做了三個實驗,相應的實驗結果如圖1所示(實驗1、 實驗2均在最適宜條件下進行,實驗3其他條件適宜),請分析回答:
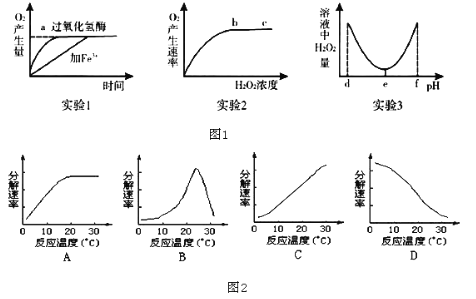
(1)實驗1,2,3中的自變量分別為______、______、______。
(2)實驗2結果反映,在b、c所對應的H2O2濃度范圍內,過氧化氫溶液濃度會______(填“升高”“降低”或“不影響”)過氧化氫酶的活性,bc段O2產生速率不再增大的原因最可能是______。
(3)實驗1若溫度升高到10℃,加過氧化氫酶的催化反應曲線斜率將______(填“增大”或“減小”);加Fe3+的催化反應曲線斜率將______(填“增大”或“減小”)。
(4)實驗3的結果顯示,過氧化氫酶的最適pH為______,實驗結果表明,當pH小于d或大于f時,過氧化氫的活性將永久喪失,其原因是______。
(5)如圖2能正確表示溫度對唾液淀粉酶活性影響曲線的是______。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】現有下列物質:①碳酸鈉 ②氧化鈉 ③二氧化硅 ④鐵 ⑤氧氣⑥氫氧化鈣 ⑦硫酸 請將上述物質按下列要求分類,并將其序號填入空白處:
(1)按組成分類,屬于單質的是 , 屬于氧化物的是 , 屬于酸的是 , 屬于堿的是 , 屬于鹽的是 .
(2)寫出①分別與⑥、⑦在溶液中反應的離子方程式:、 .
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某同學研究溫度和pH對某酶促反應速率的影響,經實驗得到如圖所示的曲線。據此圖分析,回答下列問題。

(1)該酶催化反應的最適溫度為 左右。
(2)當pH為8時,影響反應速率的主要因素是 。
(3)本實驗中需控制的無關變量是 (至少寫出兩個)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】 (2017·湖南省懷化市普通高中學生學業水平模擬考試)下列行為符合化學實驗安全要求的是
A.做實驗剩余的金屬鈉直接丟棄在廢液缸中
B.配制稀硫酸時,將水緩慢倒入濃硫酸中并不斷攪拌
C.點燃CH4前,檢驗氣體的純度
D.大量有毒氯氣(密度比空氣大)氯氣泄漏時,迅速離開現場并盡量往低處去
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某實驗小組設計了如圖裝置對焦炭還原二氧化硅的氣體產物的成分進行探究. 
已知:PdCl2溶液可用于檢驗CO,反應的化學方程式為CO+PdCl2+H2O═CO2+2HCl+Pd↓(產生黑色金屬鈀粉末,使溶液變渾濁).
(1)實驗的主要步驟如下: ①點燃酒精噴燈
②檢查裝置的氣密性
③通入N2一段時間
④向A的硬質玻璃管中裝入焦炭(過量)與二氧化硅混合物共m g則正確的操作順序是 .
(2)實驗時要通入足夠長時間的N2 , 其原因是 .
(3)裝置D中所盛試劑為(填序號)
A.NaOH溶液
B.Ca(OH)2溶液
C.PdCl2溶液
D.稀H2SO4溶液
(4)若裝置C、D中溶液均變渾濁,且經檢測兩氣體產物的物質的量相等,則A中反應的化學方程式為 . 實驗結束后,C裝置增重ng,求m g混合物中SiO2的質量分數 .
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】填空
(1)磁性氧化鐵的化學式________ ;寫出鐵與水蒸氣反應的化學方程式_____________
(2)過氧化鈉是___色固體;可用于 ________;其中氧元素的化合價___________
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某稀硫酸和稀硝酸的混合溶液200mL,平均分成兩份.向其中一份中逐漸加入銅粉,最多能溶解19.2g(已知硝酸只被還原為NO氣體).向另一份中逐漸加入鐵粉,產生氣體的量隨鐵粉質量增加的變化如圖所示.下列分析或結果錯誤的是( ) 
A.混合酸中NO3﹣物質的量為0.2mol
B.OA段產生的是NO,AB段的反應為Fe+2Fe3+=3Fe2+ , BC段產生氫氣
C.第二份溶液中最終溶質為FeSO4
D.H2SO4濃度為4molL﹣1
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com