【答案】
分析:(1)熱化學(xué)方程式書寫要求標(biāo)明各物質(zhì)的狀態(tài)、熱量用△H表示、放熱用符號(hào)“-”、吸熱用符號(hào)“+”、單位為kJ/mol,各物質(zhì)前的計(jì)量數(shù)表示物質(zhì)的量,注意熱量隨著計(jì)量數(shù)而改變;
(2)化學(xué)平衡常數(shù),是指在一定溫度下,可逆反應(yīng)達(dá)到平衡,這時(shí)各生成物濃度的化學(xué)計(jì)量數(shù)次冪的乘積除以各反應(yīng)物濃度的化學(xué)計(jì)量數(shù)次冪的乘積所得的比值是個(gè)常數(shù),用K表示,這個(gè)常數(shù)叫化學(xué)平衡常數(shù);
化學(xué)平衡常數(shù)表示反應(yīng)進(jìn)行的程度.化學(xué)平衡常數(shù)只與溫度有關(guān),吸熱反應(yīng)平衡常數(shù)隨溫度升高而增大,放熱反應(yīng)則相反;
(3)綠色化學(xué)是指設(shè)計(jì)沒有或者只有盡可能小的環(huán)境負(fù)作用并且在技術(shù)上和經(jīng)濟(jì)上可行的化學(xué)品和化學(xué)過程.它是實(shí)現(xiàn)污染預(yù)防的基本的和重要的科學(xué)手段;
(4)反應(yīng)速率的影響條件有濃度、壓強(qiáng)、溫度、催化劑、反應(yīng)物顆粒大小等.抓住溫度一定時(shí)改變壓強(qiáng)或壓強(qiáng)一定時(shí)改變溫度去進(jìn)行對(duì)比實(shí)驗(yàn)研究反應(yīng)速率;
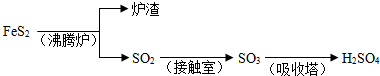
(5)根據(jù)題意,緊抓硫元素守恒分析解題;
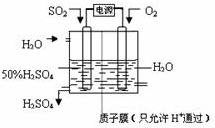
(6)電解原理:使電流通過電解質(zhì)溶液,而在陰、陽兩極引起氧化還原反應(yīng)的過程.陽極是還原劑發(fā)生氧化反應(yīng),陰極是氧化劑發(fā)生還原反應(yīng).分析出氧化劑、還原劑,結(jié)合電解質(zhì)溶液,正確書寫出電極反應(yīng).
解答:解:(1)40gSO
3氣體物質(zhì)的量為0.5mol,生成液態(tài)硫酸放出65.15kJ,
則1molSO
3氣體被水完全吸收生成液態(tài)硫酸放出130.3kJ熱量,
熱化學(xué)方程式為:SO
3(g)+H
2O(l)=H
2SO
4(l)△H=-130.3kJ/mol,
故答案為:SO
3(g)+H
2O(l)=H
2SO
4(l)△H=-130.3kJ/mol;
(2)①化學(xué)平衡常數(shù)的大小可以表示反應(yīng)進(jìn)行的程度.化學(xué)平衡常數(shù)只與溫度有關(guān),吸熱反應(yīng)平衡常數(shù)隨溫度升高而增大,放熱反應(yīng)則相反.根據(jù)表中數(shù)據(jù)可知:隨溫度升高平衡常數(shù)減小,說明正反應(yīng)為放熱反應(yīng),放熱反應(yīng)△H<0,
故SO
2(g)+

O
2(g)
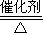
SO
3(g)△H=a kJ?mol
-1 反應(yīng)中a<0,為負(fù)值.
故答案為:<;
②A.化學(xué)平衡常數(shù)的大小可以表示反應(yīng)進(jìn)行的程度.K值越大,表明反應(yīng)進(jìn)行的程度越大,而反應(yīng)進(jìn)行的程度越大,并不意味SO
2的轉(zhuǎn)化率一定越高,故A不正確;
B.K值越大,表明反應(yīng)進(jìn)行的程度越大,而反應(yīng)進(jìn)行的程度越大,并不意味SO
3的產(chǎn)量一定越大,產(chǎn)量還取決與反應(yīng)物的投料量等因素.故B不正確;
C.化學(xué)平衡常數(shù)的大小可以表示反應(yīng)進(jìn)行的程度.K值越大,表明反應(yīng)進(jìn)行的程度越大,正反應(yīng)進(jìn)行得越完全.故C正確;
D.化學(xué)平衡常數(shù)的大小可以表示反應(yīng)進(jìn)行的程度.不表示反應(yīng)的快慢,與化學(xué)反應(yīng)速率無關(guān).故D不正確;
故答案為:C;
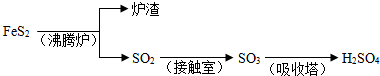
(3)A.Fe
2O
3 與CO反應(yīng)需要高溫,消耗大量能量,然后Fe與濃硫酸反應(yīng)時(shí)有二氧化硫放出,污染環(huán)境,不符合綠色化學(xué)理念.故A不正確;
B.Fe
2O
3 +3H
2SO
4 ═Fe
2(SO
4)
3 +3H
2O,F(xiàn)e
2(SO
4)
3 +Fe═3FeSO
4,反應(yīng)中無污染物產(chǎn)生,最能體現(xiàn)綠色化學(xué)理念的方案.故B正確;
C.Fe與濃硫酸反應(yīng)時(shí)有二氧化硫放出,污染環(huán)境,不符合綠色化學(xué)理念.故C不正確;
故答案為:B;
(4)
| 實(shí)驗(yàn)序號(hào) | 催化劑顆粒大小 | 溫度(K) | 壓強(qiáng)(KPa) |
| 1 | 粗顆粒 | 673 | 101Kpa增大到1010Kpa |
| 2 | 細(xì)顆粒 | 673 | 101Kpa增大到1010Kpa |
| 3 | 粗顆粒 | 673K增大到723K | 101Kpa |
| 4 | 細(xì)顆粒 | 673K增大到723K | 101Kpa |
第一組和第二組保持溫度不變,逐步增大壓強(qiáng),對(duì)比催化劑粗顆粒與細(xì)顆粒對(duì)反應(yīng)速率的影響,
第三組和第四組保持壓強(qiáng)不變,逐步升高溫度,對(duì)比催化劑粗顆粒與細(xì)顆粒對(duì)反應(yīng)速率的影響,
所以通過變換這些實(shí)驗(yàn)條件,至少需要完成4個(gè)實(shí)驗(yàn)然后進(jìn)行對(duì)比才能得出結(jié)論,
故答案為:4;
(5)設(shè)可制得石膏物質(zhì)的量為x,
22.4m
3(標(biāo)準(zhǔn)狀況下)的尾氣物質(zhì)的量為:
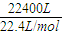
=1000mol,
尾氣中SO
2的體積分?jǐn)?shù)為0.200%,得SO
2物質(zhì)的量為:1000mol×0.200%=2mol,二氧化硫的利用率為80.0%,
反應(yīng)方程式為:CaCO
3+SO
2+H
2O═CaSO
3+CO
2↑+H
2O、2CaSO
3+O
2+4H
2O═2CaSO
4?2H
2O,
根據(jù)硫元素守恒得:SO
2 ~CaSO
4?2H
2O
1mol 1mol
2mol×80.0% x
解得:x=1.6mol,
則石膏的質(zhì)量為:1.6mol×172g/mol=275.2g≈0.28Kg,
故答案為:0.28;
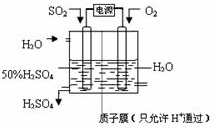
(6)電解池中陽極是還原劑發(fā)生氧化反應(yīng),陰極是氧化劑發(fā)生還原反應(yīng).根據(jù)題意可知:通入二氧化硫的電極為陽極,通入氧氣的電極為陰極,陽極反應(yīng):SO
2+2H
2O-2e
-=SO
42-+4H
+,陰極反應(yīng):O
2+4H
++4e
-═2H
2O,陰、陽電極反應(yīng)合并得總反應(yīng)為:2SO
2+O
2+2H
2O=2H
2SO
4.
故答案為:SO
2+2H
2O-2e
-=SO
42-+4H
+、2SO
2+O
2+2H
2O=2H
2SO
4.
點(diǎn)評(píng):本題涉及電解法制硫酸很有新意,能夠加深對(duì)電解原理的理解,同時(shí)涉及到化學(xué)平衡常數(shù)K、化學(xué)平衡常數(shù)的影響條件、熱化學(xué)方程式、綠色化學(xué)理念、反應(yīng)速率的影響條件比較、電化學(xué)原理等廣泛內(nèi)容,需要對(duì)知識(shí)的全面掌握,難度較大.


 O2(g)
O2(g)  SO3(g)△H=a kJ?mol-1
SO3(g)△H=a kJ?mol-1 Fe
Fe FeSO4;B.Fe2O3
FeSO4;B.Fe2O3 Fe2(SO4)3
Fe2(SO4)3 FeSO4;C.Fe2O3
FeSO4;C.Fe2O3 Fe
Fe FeSO4
FeSO4
 O2(g)
O2(g)  SO3(g)△H=a kJ?mol-1 反應(yīng)中a<0,為負(fù)值.
SO3(g)△H=a kJ?mol-1 反應(yīng)中a<0,為負(fù)值.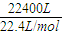 =1000mol,
=1000mol,




 O2(g)
O2(g) SO3(g)△H=a kJ?mol-1 下表為不同溫度(T)下該反應(yīng)的化學(xué)平衡常數(shù)(K):
SO3(g)△H=a kJ?mol-1 下表為不同溫度(T)下該反應(yīng)的化學(xué)平衡常數(shù)(K): Fe
Fe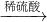 FeSO4
FeSO4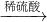 Fe2(SO4)3
Fe2(SO4)3 FeSO
FeSO 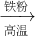 Fe
Fe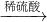 FeSO4
FeSO4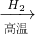 Fe
Fe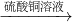 FeSO4
FeSO4