
【題目】當1,3-丁二烯和溴單質1:1加成時,其反應機理及能量變化如下:
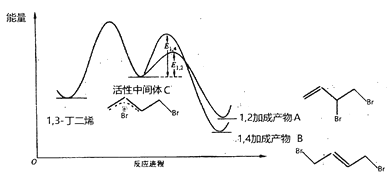
不同反應條件下,經過相同時間測得生成物組成如下表:
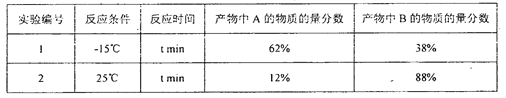
下列分析不合理的是
A. 產物A、B互為同分異構體,由中間體生成A、B的反應互相競爭
B. 相同條件下由活性中間體C生成產物A的速率更快
C. 實驗1測定產物組成時,體系己達平衡狀態
D. 實驗1在t min時,若升高溫度至25℃,部分產物A會經活性中間體C轉化成產物B
【答案】C
【解析】分析:由1,3-丁二烯和溴單質1:1加成時的反應機理及能量變化示意圖可知,該反應可以生成互為同分異構體的兩種產物A和B,由中間體生成A、B的反應互相競爭;由中間體生成A的活化能較低,故相同條件下由活性中間體C生成產物A的速率更快;實驗1測定產物組成時,無法判斷體系己達平衡狀態;由圖像可知,由C生成A和B的反應皆為放熱反應,由表中數據可知,在較高的溫度下,C轉化為B有競爭優勢,故實驗1在t min時,若升高溫度至25℃,部分產物A會經活性中間體C轉化成產物B。
詳解:A. 產物A、B互為同分異構體,由中間體生成A、B的反應互相競爭,A正確;
B. 由中間體生成A的活化能較低,故相同條件下由活性中間體C生成產物A的速率更快,B正確;
C. 實驗1測定產物組成時,無法判斷體系己達平衡狀態,C不合理;
D. 由圖像可知,由C生成A和B的反應皆為放熱反應,由表中數據可知,在較高的溫度下,C轉化為B有競爭優勢,故實驗1在t min時,若升高溫度至25℃,部分產物A會經活性中間體C轉化成產物B,D正確。
綜上所述,分析不合理的是C,本題選C。


 應用題天天練四川大學出版社系列答案
應用題天天練四川大學出版社系列答案科目:高中化學 來源: 題型:
【題目】已知A2On2﹣可將B2﹣氧化為B單質,A2On2﹣則被還原為A3+ , 又知100mL的0.3mol/L的A2On2﹣與150mL的0.6mol/L B2﹣恰好完全反應,則A2On2﹣中的n值為( )
A.4
B.5
C.6
D.7
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】如圖所示的圖解表示構成細胞的元素、化合物,a、b、c、d代表不同的小分子物質,A、B、C代表不同的大分子物質,請分析回答下列問題:
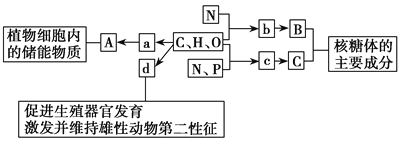
(1)物質a是_________,在動物細胞內,與物質A作用最相近的物質是_________。若物質A在動物、植物細胞中均可含有,并且作為細胞內最理想的儲能物質,不僅含能量多而且體積較小,則A是______________。
(2)物質b是____________,若某種B分子由n個b分子(平均相對分子質量為m)組成的2條鏈組成,則該B分子的相對分子質量大約為____________。
(3)物質c在人體細胞中共有_______種,分子中___________的不同決定了c的種類不同。
(4)物質d是____________,d和__________、維生素D都屬于固醇類物質。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知X、Y、Z、W、M 均為短周期元素。25℃時,其最高價氧化物對應的水化物(濃度均為0.01mol/L)溶液的pH和原子半徑的關系如圖所示。下列說法不正確的是
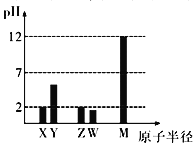
A. X、M 簡單離子半徑大小順序:X>M
B. X、Y、Z、W、M 五種元素中只有一種是金屬元素
C. Z 的最高價氧化物的化學式為ZO3
D. X、Z的最簡單氣態氫化物反應有白煙生成
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列事故處理方法正確的是
A.電線短路失火時,用大量的水滅火
B.NaOH濃溶液濺到皮膚,立即用水沖洗,然后涂上稀硼酸溶液
C.濃硫酸濺到皮膚上,立即用稀 NaOH 溶液洗滌
D.鈉著火時,立即用水滅火
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列有關實驗的說法正確的是
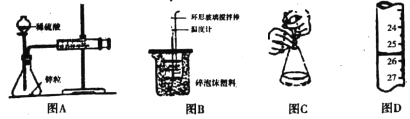
A. 圖A中測定鋅粒與1mol/L稀硫酸的反應速率,只需測定注射器中收集氫氣的體積
B. 圖B裝置中進行50mL0.50mol/L鹽酸與50mL 0.55mol/L NaOH溶液發生中和反應放出熱量的測定,使溫度計溫度升高的熱量就是中和反應生成1mol水的熱量
C. 圖C酸堿中和滴定中,可以在滴定過程中用少量水沖洗錐形瓶內壁
D. 圖D滴定管中液面位置如圖所示,則此時的讀數為26.50mL
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】乙烯是合成食品外包裝材料聚乙烯的單體,可以由丁烷裂解制備。
主反應:C4H10(g,正丁烷)![]() C2H4(g)+C2H6(g) △H1
C2H4(g)+C2H6(g) △H1
副反應:C4H10 (g,正丁烷)![]() CH4(g)+C3H6(g) △H2
CH4(g)+C3H6(g) △H2
回答下列問題:
(1)化學上,將穩定單質的能量定為0,生成穩定化合物時釋放或吸收的能量叫做生成熱,生成熱可表示該物質相對能量。下表為25℃、101kPa下幾種有機物的生成熱:
物質 | 曱烷 | 乙烷 | 乙烯 | 丙烯 | 正丁烷 | 異丁烷 |
生成熱/kJ·mol-1 | -75 | -85 | 52 | 20 | -125 | -132 |
①書寫熱化學方程式時,要標明“同分異構體名稱”,其理由是_______________________。
②上述反應中,△H1=______kJ/mol。
(2)一定溫度下,在恒容密閉容器中投入一定量正丁烷發生反應生成乙烯。
①下列情況表明該反應達到平衡狀態的是_______(填代號)。
A.氣體密度保持不變 B.[c(C2H4)·c(C2H6)]/ c(C4H10)保持不變
C.反應熱不變 D.正丁烷分解速率和乙烷消耗速率相等
②為了同時提高反應速率和轉化率,可采用的措施是________________。
(3)向密閉容器中充入丁烷,在一定條件(濃度、催化劑及壓強等)下發生反應,測得乙烯產率與溫度關系如圖所示。溫度高于600℃時,隨若溫度升高,乙烯產率降低,可能的原因是__________(填代號)。
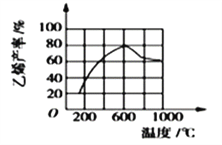
A.平衡常數降低 B.活化能降低
C.催化劑活性降低 D.副產物增多
(4)在一定溫度下向1L恒容密閉容器中充入2mol正丁烷,反應生成乙烯和乙烷,經過10min達到平衡狀態,測得平衡時氣體壓強是原來的1.75倍。
①0~10min內乙烯的生成速率v(C2H4)為________mol·L-1·min-1。
②上述條件下,該反應的平衡常數K為____________。
(5)丁烷-空氣燃料電池以熔融的K2CO3為電解質,以具有催化作用和導電性能的稀土金屬材料為電極。該燃料電池的負極反應式為______________________________。
(6)K2CO3可由二氧化碳和氫氧化鉀溶液反應制得。常溫下,向1 L pH=10的KOH溶液中持續通入CO2,通入CO2的體積(V)與溶液中水電離出的OH-濃度的關系如圖所示。C點溶液中各離子濃度大小關系為_________________________________________。
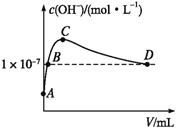
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】一定溫度時,Cu2+,Mn2+、Fe2+、Zn2+等四種金屬離子(M2+)形成硫化物沉淀所需S2-最低濃度的對數值lgc(S2-)與lgc(M2+)的關系如圖所示。下列有關判斷不正確的是
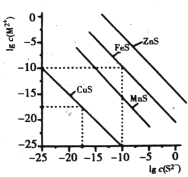
A. 該溫度下,Ksp(MnS)大于1.0×10-15
B. 該溫度下,溶解度:CuS>MnS>FeS>ZnS
C. 向含Mn2+、Zn2+的稀溶液中滴加Na2S溶液,Mn2+最有可能先沉淀
D. 向c(Fe2+)=0.1mol/L的溶液中加入CuS粉末,有FeS沉淀析出
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】現有三組溶液:①汽油和氯化鈉溶液 ②39%的乙醇溶液 ③氯化鈉和單質溴的水溶液,分離以上各混合液的正確方法依次是( )
A. 分液、蒸餾、萃取 B. 萃取、蒸發、分液
C. 分液、萃取、蒸餾 D. 蒸餾、萃取、分液
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com