
【題目】短周期元素Q、W、X、Y、Z在元素周期表中的對應位置如圖所示,其中只有Z為金屬元素。下列說法正確的是( )
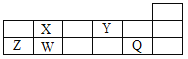
A. W、X兩元素在自然界中都存在相應的單質
B. Q、Y分別與鈉元素形成的化合物中僅含離子鍵
C. 簡單離子半徑由大到小的順序為:Q>Y>Z
D. X、Z的最高價氧化物對應的水化物之間易發(fā)生化學反應
【答案】C
【解析】試題分析:由元素所在周期表中的位置可知,X為C元素,Y為O元素,Z為Al元素,W為Si元素,Q為Cl元素。A.W為Si元素,X為C元素,C在自然界中存在單質,Si為親氧元素,在自然界中全部以化合態(tài)存在,故A錯誤;B.Y為O元素,Q為Cl元素,O與活潑金屬形成的化合物中可以含有共價鍵,如過氧化鈉中存在離子鍵和共價鍵,故B錯誤;C.電子排布相同的離子,原子序數(shù)越大,離子半徑越小,電子層數(shù)越多,離子半徑越大,簡單離子半徑由大到小的順序為:Cl->O2->Al3+,故C正確;D.X為C元素,Z為Al元素,C的最高價氧化物的水化物為弱酸,與氫氧化鋁不反應,故D錯誤。故選C。


 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源: 題型:
【題目】下列說法正確的是
A. 水分子間存在氫鍵,所以水分子比較穩(wěn)定
B. H2SO4溶于水能電離出H+和SO42-,所以硫酸是離子化合物
C. I2加熱升華過程中只需克服分子間作用力
D. SiO2熔化破壞共價鍵和分子間作用力
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列實驗操作均要用玻璃棒,其中玻璃棒的作用及其目的相同的是 ①過濾 ②蒸發(fā) ③溶解 ④向容量瓶轉移液體
A. ①和② B. ①和③ C. ③和④ D. ①和④
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】主族元素在周期表中的位置取決于( )
A.元素原子核內的中子數(shù)
B.元素的最高正化合價
C.元素原子的電子層數(shù)
D.元素原子核外的電子層數(shù)和最外層上的電子數(shù)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】一定溫度下,將一定量的冰醋酸加水稀釋,稀釋過程中溶液的導電性變化如圖所示。則下列說法錯誤的是
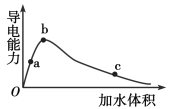
A.醋酸的電離程度:a<b<c
B.溶液的pH值:b>a>c
C.蘸取c點溶液滴在濕潤的pH試紙上,測得pH值一定偏大
D.若分別向a、b、c三點的溶液中,加入同濃度的氫氧化鈉溶液中和,消耗NaOH溶液的體積a=b=c
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】NaH與水反應的化學方程式為NaH+H2O=NaOH+H2↑,下列有關該反應的說法正確的是
A. H2O是還原劑 B. NaH被還原
C. H2O失去電子 D. NaH發(fā)生氧化反應
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】紅礬鈉(重鉻酸鈉:![]() )是重要的基本化工原料,應用十分廣泛。工業(yè)制備紅礬鈉的流程如下:
)是重要的基本化工原料,應用十分廣泛。工業(yè)制備紅礬鈉的流程如下:
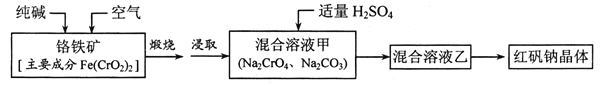
請回答下列問題:
(1)![]() 的基態(tài)電子排布式為____________。
的基態(tài)電子排布式為____________。
(2)鍛燒鉻鐵礦發(fā)生反應:____________![]() 配平上述化學反應方程式。
配平上述化學反應方程式。
(3)溶液甲中加入H2SO4時,可以觀察到溶液由黃色變?yōu)槌壬⒎懦鰺o色氣體,有 關反應的離子方程式為____________。
(4)制備紅礬鈉的廢水必須進行處理。首先酸化廢水,將含+6價鉻的酸性廢液放入電解槽內,用鐵作陽極進行電解,陰極析出H2,陽極產物被![]() 氧化然后轉化為Cr(OH)3、 Fe(0H)3 沉淀。
氧化然后轉化為Cr(OH)3、 Fe(0H)3 沉淀。
①陽極的電極反應式為(不考慮后續(xù)反應):____________。
②溶液中金屬離子在陰極區(qū)可沉淀完全,從水的電離平衡角度解釋其原因:______。
③已知某含![]() 的酸性廢水中Cr元素的含量是52.5mg/L,處理后Cr元素最高允許 排量為0.5 mg/L。要處理100 m3廢水達到排放標準,至少消耗鐵_____kg。
的酸性廢水中Cr元素的含量是52.5mg/L,處理后Cr元素最高允許 排量為0.5 mg/L。要處理100 m3廢水達到排放標準,至少消耗鐵_____kg。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知25 ℃時,CaSO4在水中的沉淀溶解平衡曲線如圖所示,該條件下向100 mL的CaSO4飽和溶液中,加入200 mL 0.03 mol·L -1 的Na2SO4溶液,針對此過程的下列敘述正確的是(忽略混合過程中的體積變化)
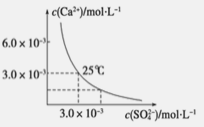
A.溶液中析出CaSO4沉淀,最終溶液中c(SO42-)較原來大
B 溶液中析出CaSO4沉淀,溶液中c(Ca2+ )、c(SO 42-)都變小
C.溶液中無沉淀析出,溶液中c(Ca2+ )、c(SO42-)都變小
D.溶液中無沉淀析出,但最終溶液中c(SO42-)較原來大
查看答案和解析>>
國際學校優(yōu)選 - 練習冊列表 - 試題列表
湖北省互聯(lián)網違法和不良信息舉報平臺 | 網上有害信息舉報專區(qū) | 電信詐騙舉報專區(qū) | 涉歷史虛無主義有害信息舉報專區(qū) | 涉企侵權舉報專區(qū)
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com