
【題目】氯氧化銅[xCuO·yCuCl2·zH2O]在農業上用作殺菌劑。工業上用銅礦粉(主要含Cu2(OH)2CO3、Fe3O4等)為原料制取氯氧化銅的流程如下:

⑴“調節pH”并生成Fe(OH)3時反應的離子方程式為______。
⑵調節pH,要使常溫溶液中c(Cu2+)≥0.022mol·L-1,而c(Fe3+)≤1×10-6mol·L-1,則應調節pH的范圍為______。{已知Ksp[Cu(OH)2=2.2×10-20],Ksp[Fe(OH)3=1×10-36]}
⑶為測定氯氧化銅的組成,現進行如下實驗:
步驟Ⅰ:稱取0.4470 g氯氧化銅,放入錐形瓶,加入一定量30%的硝酸使固體完全溶解。滴加K2CrO4溶液作指示劑,用0.1000mol·L-1 AgNO3標準溶液滴定溶液中的Cl-,滴定至終點時消耗AgNO3標準溶液20.00 mL;
步驟Ⅱ:稱取0.4470g氯氧化銅,放入錐形瓶,加入一定量硫酸使固體完全溶解。向溶液中加入過量的KI固體,充分反應后向溶液中滴入數滴淀粉溶液,用0.2000mol·L-1Na2S2O3標準溶液滴定,滴定至終點時消耗Na2S2O3標準溶液20.00mL。
已知步驟Ⅱ中所發生的反應如下:
2Cu2++4I-=2CuI↓+I2 2Na2S2O3+I2=2NaI+Na2S4O6
①已知Ag2CrO4為磚紅色沉淀,步驟Ⅰ滴定終點時的實驗現象是_______。
②通過計算確定氯氧化銅的化學式________________(寫出計算過程)。
【答案】4Fe3++3Cu2(OH)2CO3+3H2O=4Fe(OH)3+6Cu2++3CO2↑ [4,5] 當加入最后一滴AgNO3溶液時,出現磚紅色沉淀 3CuO·CuCl2·4H2O
【解析】
銅礦粉溶于鹽酸溶液中,含有Cu2+、Fe2+、Fe3+,加雙氧水將Fe2+氧化成Fe3+,此時溶液中存在著Fe3+的水解平衡,加入堿式碳酸銅調節pH值,使Fe3+轉化成沉淀除去。加入石灰乳將Cu2+沉淀: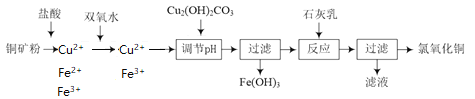
(1)Fe3+水解平衡:Fe3++3H2O![]() Fe(OH)3+3H+,Cu2(OH)2CO3消耗H+, H+濃度減小使平衡正向移動, Fe3+轉化成氫氧化鐵沉淀而除去,Cu2(OH)2CO3+4H+=2Cu2++CO2↑+3H2O,將倆方程式加和就得到了:4Fe3++3Cu2(OH)2CO3+3H2O=4Fe(OH)3+6Cu2++3CO2↑。
Fe(OH)3+3H+,Cu2(OH)2CO3消耗H+, H+濃度減小使平衡正向移動, Fe3+轉化成氫氧化鐵沉淀而除去,Cu2(OH)2CO3+4H+=2Cu2++CO2↑+3H2O,將倆方程式加和就得到了:4Fe3++3Cu2(OH)2CO3+3H2O=4Fe(OH)3+6Cu2++3CO2↑。
(2)使溶液中的Fe3+完全變成沉淀時的pH計算:Ksp[Fe(OH)3]=1×10-36=c(Fe3+)×c3(OH—),c(Fe3+)=1×10-6molL—1,解得c(OH—)=1×10—10molL—1,pH=4;使常溫溶液中c(Cu2+)≥0.022mol·L-1 pH計算:Ksp[Cu (OH)2]=2.2×10—20=c(Cu2+)×c2(OH—),c(Cu2+)=0.022molL—1,解得c(OH—)=1×10—9molL—1,pH=5;故pH 范圍:[4,5]。
(3)①當氯離子已沉淀完全,多加入一滴AgNO3溶液時,CrO42—開始沉淀出現磚紅色。
②n(Cl—)=n(AgNO3)=0.1000 mol·L-1×0.02 L=0.002 mol,由方程式知:Cu2+ ~ Na2S2O3,n(Cu2+ ) = n(Na2S2O3)= 0.2000 mol·L-1×0.02 L=0.004 mol,結合氯氧化銅化學式[xCuO·yCuCl2·zH2O]得:n(CuO)= 0.003 mol,n(CuCl2)= 0.001 mol,
n(H2O)=![]() = 0.004 mol,n(CuO):n(CuCl2):n(H2O)=x:y:z=3:1:4,故氯氧化銅的化學式:3CuO·CuCl2·4H2O
= 0.004 mol,n(CuO):n(CuCl2):n(H2O)=x:y:z=3:1:4,故氯氧化銅的化學式:3CuO·CuCl2·4H2O


 千里馬走向假期期末仿真試卷寒假系列答案
千里馬走向假期期末仿真試卷寒假系列答案科目:高中化學 來源: 題型:
【題目】在25℃時,將1.0L c mol·L-1 CH3COOH溶液與0.1mol NaOH固體混合,使之充分反應。然后向該混合溶液中通入HCl氣體或加入NaOH固體(忽略體積和溫度變化),溶液pH隨通入(或加入)物質的物質的量的變化如圖所示。下列敘述錯誤的是( )
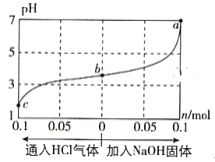
A. 水的電離程度:a>b>c
B. c點對應的混合溶液中:c(CH3COOH)>c(Na+)>c(OH-)
C. a點對應的混合溶液中:c(Na+)=c(CH3COO-)
D. 該溫度下,CH3COOH的電離平衡常數![]()
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】氯堿工業是一種高耗能產業,一種將燃料電池與電解池組合的新工藝可節能30%以上,下圖是該工藝圖示(電極未標出)。
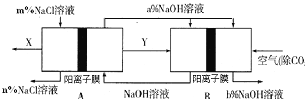
下列說法正確的是
A.X為H2,Y為Cl2
B.A池為電解池,且m<n
C.B池為燃料電池,且a<b
D.該工藝優點是燃料電池提供電能且能提高燒堿產品的濃度
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】位于不同主族的四種短周期元素甲、乙、丙、丁,其原子序數依次增大,原子半徑r(丁)>r(乙)>r(丙)>r(甲)。四種元素中,只有一種為金屬元素,乙和丙原子的最外層電子數之和為丁原子的最外層電子數的3倍。據此推斷,下述正確的是
A.簡單氫化物的沸點:乙>丙
B.由甲、乙兩元素組成的化合物溶于水呈堿性
C.丙和丁兩元素的最高價氧化物的水化物之間能發生反應
D.由甲和丙兩元素組成的分子,不可能含非極性鍵
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】藥物阿佐昔芬G主要用于防治骨質疏松癥和預防乳腺癌。合成路線如下:

⑴A中官能團的名稱為_______;B→C的反應類型是_______。
⑵試劑M的分子式為C7H8OS,寫出M的結構簡式_______。
⑶D的一種同分異構體X同時滿足下列條件,寫出X的結構簡式:______。
Ⅰ.能與FeCl3溶液發生顯色反應,1 mol X最多可以消耗足量溴水中1 mol Br2;
Ⅱ.核磁共振氫譜上有4種不同化學環境的氫原子。
⑷![]() 是合成所需的原料之一,它的一種同分異構體Y同時滿足下列條件,寫出Y的結構簡式:_______。
是合成所需的原料之一,它的一種同分異構體Y同時滿足下列條件,寫出Y的結構簡式:_______。
Ⅰ.屬于α-氨基酸; Ⅱ.含苯環,核磁共振氫譜上有6種不同化學環境的氫原子。
⑸請以CH2=CH2和![]() 為原料制備
為原料制備 的合成路線圖____________________。(無機試劑任用,合成路線圖示例見題干)
的合成路線圖____________________。(無機試劑任用,合成路線圖示例見題干)
⑹已知:![]() 。請寫出以
。請寫出以 和CH3Br為原料制備
和CH3Br為原料制備 的合成路線圖______________________________________。(無機試劑任用,合成路線圖示例見題干)。
的合成路線圖______________________________________。(無機試劑任用,合成路線圖示例見題干)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】二氧化硫能起漂白、保鮮作用,使物品顏色顯的白亮、鮮艷。如圖,在注射器中加入少量Na2SO3晶體,并吸入少量濃硫酸(以不接觸紙條為準)。下列有關說法正確的是
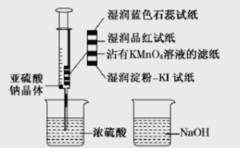
A.藍色石蕊試紙變紅后褪色
B.NaOH溶液可用于除去實驗中多余的SO2
C.濕潤淀粉-KI試紙未變藍,說明SO2有還原性
D.品紅試紙、沾有KMnO4溶液濾紙均褪色,證明了SO2的漂白性
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】工業制得的氮化鋁(AlN)產品中常含有少量Al4C3、Al2O3、C等雜質。某同學設計如下實驗分別測定氮化鋁(AlN)樣品中AlN和Al4C3的質量分數(忽略NH3在強堿性溶液中的溶解)。
(1)實驗原理:
①Al4C3與硫酸反應可生成CH4;
②AIN溶于強酸產生銨鹽,溶于強堿生成氨氣,請寫出AlN與NaOH溶液反應的化學方程式:__________________________________________________________________
(2)實驗裝置(如圖所示,量氣管為堿式滴定管改裝)
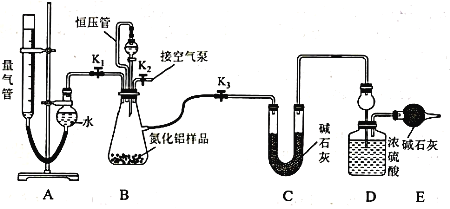
連好裝置后,首先應進行的操作是_____________________________________ 。
(3)實驗過程:稱得裝置D的初始質量為y g;稱取x g AlN樣品置于裝置B錐形瓶中,各裝置中加入相應藥品,重新連好裝置;讀取量氣管的初始讀數為a mL(量氣裝置左右液面相平)。
①欲首先測量Al4C3質量分數的有關數據,對K1、K2、K3三個活塞的操作是關閉活塞_______,打開活塞______。
②若無恒壓管,對所測氣體體積的影響是_______(填“偏大”、“偏小”或“無影響”)。
③量氣管中液面不再發生變化,說明反應已經結束。讀取讀數之前,應對量氣管進行的操作為 ______________________________________ ;若量氣管中的液面高于右側球形容器中的液面,所測氣體的體積_________(填“偏大”、“偏小”或“無影響”)。
④記錄滴定管的讀數為b mL(已知:該實驗條件下的氣體摩爾體積為Vm L· mol-1),則Al4C3的質量分數為___________(用可能含a、b、x、y、Vm的代數式表示)。
⑤測量AlN質量分數的數據:首先關閉活塞K1,打開活塞K3,通過分液漏斗加入過量NaOH溶液,與裝置B瓶內物質充分反應;反應完成后,___________________________(填該步應進行的操作),最后稱得裝置D的質量為z g。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】研究氮族元素有關物質的結構、性質和轉化有重要意義。
⑴已知P4、P4O6的結構及所含化學鍵鍵能如下:
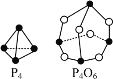
化學鍵 | P-P | P-O | O=O |
鍵能(kJ·mol-1) | a | b | c |
則P4燃燒的熱化學反應方程式:P4(s)+3O2(g)=P4O6(s) ΔH=_______kJ·mol-1。
⑵亞磷酸(H3PO3) 是一種精細化工產品。已知25℃時,亞磷酸(H3PO3)的Ka1=5×10-2,Ka2=2.5×10-7。0.1 mol·L-1 NaH2PO3溶液中H3PO3、H2PO![]() 、HPO
、HPO![]() 的濃度由大到小的順序是_______。
的濃度由大到小的順序是_______。
⑶雌黃(As2S3)和雄黃(As4S4)早期都曾用作繪畫顏料,又都因有抗病毒療效而用來入藥。一定條件下,雌黃和雄黃的轉化關系如圖1所示。
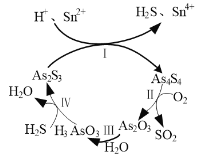
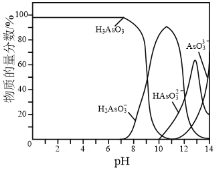
圖1 圖2
①反應Ⅰ的離子方程式為______。
②反應Ⅱ中,若1 mol As4S4參加反應,轉移電子的物質的量為______。
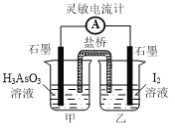
⑷常溫下,用NaOH溶液滴定H3AsO3溶液,含As微粒的物質的量分數隨pH的變化如圖2所示。
①將NaOH溶液滴加到滴有酚酞的H3AsO3溶液中,當溶液由無色變為紅色時主要反應的離子方程式為______。
②一定條件下H3AsO3可發生如下反應: H3AsO3+I2+H2O![]() H3AsO4+2H++2I-利用該反應可設計如圖所示的原電池。負極的電極反應式為_______。當反應達到平衡后,向甲中加
H3AsO4+2H++2I-利用該反應可設計如圖所示的原電池。負極的電極反應式為_______。當反應達到平衡后,向甲中加
入NaOH,鹽橋中陰離子_______(填“向甲池”、 “向乙池”或“不”)移動。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】丙烯是石油化工的重要原料,一定條件下可發生下列轉化:
已知:![]()
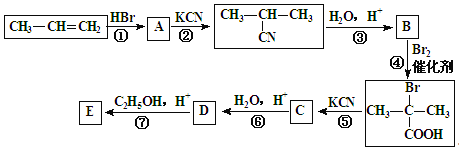
(1)A的結構簡式為:______________________;
(2)反應④的類型為:______________________反應;
(3) D與足量乙醇反應生成E的化學方程式為:______________________________________。
(4)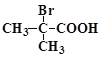 與足量NaOH溶液反應的化學方程式為___________________________。
與足量NaOH溶液反應的化學方程式為___________________________。
(5)B的同分異構體有多種.寫出其中既能發生銀鏡反應,又能發生酯化反應的2種同分異構體的結構簡式:___________________________、_______________________________。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com