
當三份銅粉分別與過量的稀硝酸、濃硝酸、熱的濃硫酸充分反應后,收集到的氣體在相同狀況下體積相等時(不考慮NO2轉化為N2O4 、生成氣體溶解及產生水蒸氣的體積),其三份銅的質量比為
(2)1.28克銅與適量的濃硝酸反應,銅完全溶解,共收集到672 ml NO、NO2混合氣(標準狀況),則反應中共消耗HNO3的物質的量為
(3)用20ml 18.4 mol/L濃硫酸和銅共熱一段時間后,冷卻、過濾,將濾液稀釋到100ml,測得溶液中SO42— 的濃度為3.18mol/L,則該溶液CuSO4的物質的量濃度為
(4)Na2SiO3可以改寫成氧化物的形式為Na2O·SiO2,則質量分數為98%的濃硫酸改寫成氧化物的形式為 。
(11分)(1) 3:1:2 (2)0.07 mol (3) 0.5 mol/L (4) SO3· H2O
H2O
解析試題分析:(1)銅與稀硝酸、濃硝酸和濃硫酸反應的化學方程式分別是3Cu + 8HNO3(稀)=3Cu(NO3)2 + 2NO↑+ 4H2O、Cu + 4HNO3(濃)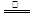 Cu(NO3)2 + 2NO2↑+ 2H2O、Cu+2H2SO4(濃)
Cu(NO3)2 + 2NO2↑+ 2H2O、Cu+2H2SO4(濃)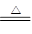 CuSO4+2H2O+SO2↑。當反應中生成當氣體體積相等時(假設均是2mol),則根據方程式可知,消耗銅的質量之比是3:1:2。
CuSO4+2H2O+SO2↑。當反應中生成當氣體體積相等時(假設均是2mol),則根據方程式可知,消耗銅的質量之比是3:1:2。
(2)1.28g銅的物質的量是1.28g÷64g/mol=0.02mol,則生成硝酸銅就是0.02mol。672 ml NO、NO2混合氣(標準狀況)的物質的量是0.672L÷22.4L/mol=0.03mol,實驗根據氮原子守恒可知,參加反應的硝酸的物質的量是0.02mol×2+0.03mol=0.07mol。
(3)反應前濃硫酸的物質的量是0.02L×18.4mol/L=0.368mol,反應后溶液中SO42-的物質的量是0.10L×3.18mol/L=0.3186mol,則根據S原子守恒可知,反應中生成SO2的物質的量是0.368mol-0.318mol=0.05mol,所以根據電子得失守恒可知,參加反應的銅的物質的量是0.05mol,則硫酸銅的物質的量是0.05mol,其濃度是0.05mol÷0.1L=0.5mol/。
(4)98%的濃硫酸中硫酸和水的物質的量之比是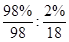 =9:1,由于硫酸可以看作是SO3·H2O,所以98%的濃硫酸改寫成氧化物的形式為SO3·
=9:1,由于硫酸可以看作是SO3·H2O,所以98%的濃硫酸改寫成氧化物的形式為SO3· H2O。
H2O。
考點:銅和硝酸以及濃硫酸反應的有關計算
點評:該題是中等難度的試題,試題基礎性強,難易適中,注重解題的靈活性,有利于培養學生的邏輯推理能力和發散思維能力。明確反應的原理并能依據守恒法答題是關鍵。守恒法是計算題中最常用也是最重要的解題方法,常見守恒法有質量守恒、原子守恒、電荷守恒、電子的得失守恒等,需要平時學習中注意積累和總結。


 名校課堂系列答案
名校課堂系列答案科目:高中化學 來源: 題型:填空題
現有m g某氣體,它由四原子分子構成,它的摩爾質量為M g·mol-1。則:
(1)該氣體的物質的量為____ ____。
(2)該氣體中所含的原子總數為________個。
(3)該氣體在標準狀況下的體積為________L。
(4)該氣體溶于1 L水中(不考慮反應),其溶液中溶質的質量分數為________。
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
元素周期表是學習和研究化學的重要工具。按要求回答下列問題:
A、B、C、D、E是短周期元素,其原子序數依次增大。A、C兩元素的最外層只有一個電子,C離子的電子層結構與周期表中非金屬性最強的元素的陰離子的電子層結構相同;元素A可以和B形成A2B和A2B2兩種分子;化合物甲和乙的每個分子中均含有5個原子,甲是由元素D與A組成,其分子的核外電子總數為18,乙是由元素D與E組成;化合物丙是由C與E組成的。
(1)元素B、D、E的元素符號依次為_______、_______、______。
(2)上述5種元素形成的分子中,除甲分子外,核外電子總數也為18的有___(填分子式)
(3)D的氧化物在高溫下可以與C的碳酸鹽發生反應,其化學反應方程式為________;化合物乙遇水劇烈反應有白霧生成,其反應的化學方程式為___________。
(4)用500mL容量瓶配制400mL 1mol/L的丙溶液,需要丙的質量為________;配制過程中除用到容量瓶外,還需要的玻璃儀器有___________________。電解所配制的400mL溶液,當電路中通過1mol電子時,理論上可收集到的氣體在標準狀況下的體積為_________L。
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
Na、Fe、Cu、Al是常見的金屬元素,請按要求回答下列問題:
(1)一定條件下,2.3g的Na完全與O2反應生成3.6g產物時失去的電子數為______。
(2)向氯化銅溶液中加入一定量的鐵粉和鋁粉混合物,充分反應后,下列情況可能出現的是______(填編號)。
a.溶液中有Cu2+、Fe2+、Al3+,不溶物為Cu b.溶液中有Fe2+、Al3+,不溶物為Cu、Fe
c.溶液中有Fe3+、Al3+,不溶物為Cu d.溶液中有Fe2+,不溶物為Cu、Al
(3)將一定質量的鐵、鋁、銅合金,加入lL一定物質的量濃度的硝酸中,合金完全溶解,測得溶液中(忽略溶液體積的變化)c(H+)=0.5mol/L、c(Cu2+)=0.3mol/L、c(Al3+)=0.2mol/L、c(NO3-)=2mol/L,則混合物中鐵的質量為______。
(4)鐵的某種氧化物的化學式表示為FexO(x<1),已知鐵元素在該氧化物中的質量分數為75%,則x=______ (精確至0.01)。
(5)Na-AI/FeS是一種可充電電池,電池中用含Na+導電固體作為電解質,在工作過程中Na+的物質的量保持不變。
①若該正極的電極反應式表示為:2Na++FeS+2e-=Na2S+Fe,則電池的負極反應式可表示為_____;充電時,陽極發生反應的物質是______。
②用該電池作電源,組成如圖所示裝置,若通電5min時,銅電極質量增加1.08 g,則該電源電極X名稱為______。圖中裝置A、C的pH變化為:A ______、C ______(填“增大”“減小”或“不變”)。
查看答案和解析>>
科目:高中化學 來源: 題型:計算題
實驗室常用鹽酸的質量分數為36.5%,密度為1.20g/㎝3。
⑴此濃鹽酸的物質的量濃度是多少?(列式計算)
⑵配制100mL3.00mol/L的鹽酸,需以上濃鹽酸多少mL?(列式計算)
⑶用濃鹽酸配制該稀鹽酸需要以下哪些步驟(按操作順序填寫序號): 。
①計算 ②裝瓶③用50 mL量筒量取一定體積的濃鹽酸④洗滌⑤移液⑥稀釋⑦定容⑧搖勻
查看答案和解析>>
科目:高中化學 來源: 題型:計算題
向兩燒杯中加入相同體積的1.5mol/L的稀硫酸,置于天平的左右兩托盤上,調節天平,使之達到平衡,向一個燒杯中加入5.4g鎂,另一個燒杯中加入5.4g鋁,試根據計算進行分析,當硫酸取不同體積時,反應完畢后,天平可能會發生的變化。
查看答案和解析>>
科目:高中化學 來源: 題型:計算題
已知NaCl(s)+H2SO4(濃) NaHSO4 + HCl↑,現有117g NaCl晶體和足量的濃硫酸完全反應。求:
NaHSO4 + HCl↑,現有117g NaCl晶體和足量的濃硫酸完全反應。求:
(1)產生的HCl在標況時的體積為多少?
(2)將所得HCl氣體溶于水中,配成500mL鹽酸溶液,則鹽酸的物質的量濃度為多少?
查看答案和解析>>
科目:高中化學 來源: 題型:計算題
從100 mL某種待測濃度的 H2SO4溶液中取出25 mL,加入10 mL 0.5 mol·L-1 BaCl2溶液,恰好完全反應。求:
①得到 BaSO4沉淀多少克 ?
②待測 H2SO4溶液中溶質的物質的量濃度是多少?
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com