
【題目】粉煤灰是燃煤電廠排出的主要固體廢物.我國火電廠粉煤灰的主要氧化物組成為![]() 、
、![]() 、CaO等.一種利用粉煤灰制取氧化鋁的工藝流程如下:
、CaO等.一種利用粉煤灰制取氧化鋁的工藝流程如下:

(1)粉煤灰研磨的目的是____________.
(2)第1次過濾時濾渣的主要成分有____________![]() 填化學式,下同
填化學式,下同![]() 和____________,第3次過濾時濾渣的成分是____________
和____________,第3次過濾時濾渣的成分是____________
(3)在![]() 用硫酸浸取時,鋁的浸取率與時間的關系如圖1,適宜的浸取時間為____________h;鋁的浸取率與
用硫酸浸取時,鋁的浸取率與時間的關系如圖1,適宜的浸取時間為____________h;鋁的浸取率與 的關系如圖2所示,從浸取率角度考慮,三種助溶劑
的關系如圖2所示,從浸取率角度考慮,三種助溶劑![]() F、KF及
F、KF及![]() 與KF的混合物,在
與KF的混合物,在 相同時,浸取率最高的是____________
相同時,浸取率最高的是____________![]() 填化學式
填化學式![]() ;用含氟的化合物作這種助溶劑的缺點是____________
;用含氟的化合物作這種助溶劑的缺點是____________![]() 舉一例
舉一例![]() .
.

(4)流程中循環使用的物質有____________和____________![]() 填化學式
填化學式![]()
(5)用鹽酸溶解硫酸鋁晶體,再通入HCl氣體,析出![]() ,該過程能夠發生的原因是____________
,該過程能夠發生的原因是____________
(6)用粉煤灰制取含鋁化合物的主要意義是____________.
【答案】增大反應物的接觸面積,提高浸取速率和浸出率 ![]()
![]()
![]() 2
2 ![]() 生產過程中會產生污染環境的HF和
生產過程中會產生污染環境的HF和![]() 等
等 ![]()
![]() 通入氯化氫使
通入氯化氫使![]() 達到飽和,而硫酸鋁不飽和 使廢棄固體資源化利用
達到飽和,而硫酸鋁不飽和 使廢棄固體資源化利用
【解析】
粉煤灰的主要氧化物組成為SiO2、Al2O3、CaO等,加入硫酸溶液使Al2O3溶解,CaO通過反應生成CaSO4,CaSO4微溶,大部分CaSO4和SiO2一起成為濾渣,過濾后將濾液冷卻結晶得Al2(SO4)3,用鹽酸溶解Al2(SO4)3,再通入氯化氫得AlCl36H2O晶體和硫酸溶液,過濾得硫酸溶液可以再循環利用,AlCl36H2O晶體溶解后得氯化鋁溶液中通入氨氣得氫氧化鋁沉淀和氯化銨溶液,氯化銨溶液可以循環利用,氫氧化鋁沉淀受熱分解生成Al2O3,據此答題。
(1)粉煤灰研磨的目的是增大反應物的接觸面積,提高浸取速率和浸出率,故答案為:增大反應物的接觸面積,提高浸取速率和浸出率;
(2)通過上面的分析可知,第1次過濾時濾渣的主要成分有SiO2和CaSO4,第3次過濾時濾渣的成分是Al(OH)3,故答案為:SiO2;CaSO4;Al(OH)3;
(3)根據圖1可知,2h時鋁的浸出率達到最大值,所以適宜的浸取時間為2h,根據圖2可知,在![]() 相同時,NH4F助溶劑對鋁的浸出率最高,用含氟的化合物作這種助溶劑的缺點是生產過程中會產生污染環境的HF和NH3等,故答案為:2;NH4F;生產過程中會產生污染環境的HF和NH3等;
相同時,NH4F助溶劑對鋁的浸出率最高,用含氟的化合物作這種助溶劑的缺點是生產過程中會產生污染環境的HF和NH3等,故答案為:2;NH4F;生產過程中會產生污染環境的HF和NH3等;
(4)根據上面的分析可知,流程中循環使用的物質有H2SO4和NH4Cl,故答案為:H2SO4;NH4Cl;
(5)用鹽酸溶解硫酸鋁晶體,再通入HCl氣體,析出A1C136H2O,該過程能夠發生的原因是通入氯化氫使A1C136H2O達到飽和,而硫酸鋁不飽和,便于A1C136H2O析出,故答案為:通入氯化氫使A1C136H2O達到飽和,而硫酸鋁不飽和;
(6)用粉煤灰制取含鋁化合物的主要意義在于使廢棄固體資源化利用,故答案為:使廢棄固體資源化利用。


 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源: 題型:
【題目】常溫下,下列各組離子在指定溶液中能大量共存的是( )
A.無色透明的溶液中: Fe3+、Mg2+、SCN 、Cl –
B.![]() =1×10-12的溶液中:K+、Na+、CO
=1×10-12的溶液中:K+、Na+、CO![]() 、NO
、NO![]()
C.![]() 的溶液中: K+、NH
的溶液中: K+、NH![]() 、MnO
、MnO![]() 、SO
、SO![]()
D.能使甲基橙變紅的溶液中: Na+、NH![]() 、SO
、SO![]() 、HCO
、HCO![]()
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】糖類、油脂、蛋白質都是與生命息息相關的物質,下列有關說法正確的是![]()
![]()
A.葡萄糖和蔗糖是同系物,淀粉和纖維素是同分異構體
B.淀粉、纖維素、油脂、蛋白質都是高分子化合物,都能發生水解反應
C.“春蠶到死絲方盡,蠟炬成灰淚始干”中的“絲”“淚”分別是纖維素和油脂
D.通過灼燒時產生的氣味可以鑒別蠶絲和棉紗
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】2019年諾貝爾化學獎頒給了對鋰離子電池研發作出卓越貢獻的三位科學家。筆記本電腦的電池常用鈷酸鋰電池,其工作原理如下圖所示,總反應為LixC6+Li1-xCoO2 ![]() C6+LiCoO2。下列說法不正確的是
C6+LiCoO2。下列說法不正確的是

A.放電時,負極的電極反應式:LixC6-xe-=xLi++C6
B.放電時,電子由負極經導線、用電器、導線到正極
C.充電時,陽極的電極反應式:LiCoO2-xe-=xLi++Li1-xCoO2
D.充電時,當導線中傳遞1mol電子,理論上將有1mol Li+向B極移動
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】將4molA氣體和2molB氣體充入到1L的密閉容器中,在一定條件下發生如下反應:2A(g)+ B(g)2C(g)。經2s后達到平衡時,測得C的物質的量為1.2 mol。下列說法中正確的是
A.平衡時,A物質的濃度為2.8 mol·L-1
B.平衡時,B的轉化率為70%
C.反應后混合氣體的總物質的量為5.2mol
D.用C表示平均反應速率為1.2mol·L-1·s-1
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】乙醛在氧化銅作催化劑的條件下,可以被空氣氧化成乙酸。依據此原理設計實驗制得并在試管C中收集到少量乙酸溶液(如圖所示,試管A中裝有40%的乙醛水溶液、氧化銅粉末;燒杯B中裝有某液體)。已知在60℃~80℃時用雙連打氣球鼓入空氣即可發生乙醛的氧化反應,連續鼓入十幾次反應基本完全。有關物質的沸點見表:
物質 | 乙醛 | 乙酸 | 甘油 | 乙二醇 | 水 |
沸點(℃) | 20.8 | 117.9 | 290 | 197.2 | 100 |

請回答下列問題:
(1)試管A內在60℃~80℃時發生的主要反應的化學方程式為_______________。
(2)如圖所示在實驗的不同階段,需要調整溫度計在試管A內的位置,在實驗開始時溫度計水銀球的位置應在試管A的反應液中;目的是___________;當試管A內的主要反應完成后溫度計水銀球的位置應在試管A的支管口處;目的是_________。
(3)燒杯B的作用是使試管A內的反應液均勻受熱發生反應,使生成的乙酸變成蒸氣進入試管C,燒杯B內盛裝的液體可以是____。(寫出一種即可,在題給物質中找);某同學認為試管C最好置于冰水浴中,其目的是________。
(4)對C中產品進行蒸餾時,蒸餾燒瓶中加入少量___,以除去其中含有的少量水。
A.濃硫酸 B.CaO C.CuSO4溶液 D.無水CaCl2
(5)以下區分乙酸精品和粗品的方法,合理的是_____。
A.加入水觀察實驗現象
B.加入足量氫氧化鈉溶液后,再加入銀氨溶液,水浴加熱觀察實驗現象
C.加入碳酸氫鈉溶液,振蕩后觀察實驗現象
D.加入少量Na單質,振蕩后觀察實驗現象
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】含氮類化合物在人類的日常生活中有著重要的作用。
(1)研究表明,在200℃,壓強超過200MPa時,不使用催化劑,氨便可以順利合成。但工業上合成NH3往往在溫度500℃壓強20~50MPa的條件下進行,已知合成氨為放熱反應,試分析原因_____________。
(2)工業上常利用4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g)生產硝酸。在同溫條件下,向2L的反應容器中充入2mol NH3與2.75molO2,平衡時NH3轉化率為50%,則該溫度下K=___;保持溫度不變,增大壓強,則平衡常數_____(填“增大”、“減小”或“不變”);其他條件不變,下列措施一定可以增大氨氣轉化率的是____。
4NO(g)+6H2O(g)生產硝酸。在同溫條件下,向2L的反應容器中充入2mol NH3與2.75molO2,平衡時NH3轉化率為50%,則該溫度下K=___;保持溫度不變,增大壓強,則平衡常數_____(填“增大”、“減小”或“不變”);其他條件不變,下列措施一定可以增大氨氣轉化率的是____。
A.降低氨氣濃度 B.增大容器體積 C.降低溫度 D.移除水蒸氣 E.選擇合適的催化劑
(3)已知:A.2NH3(g)+CO2(g)NH2COONH4(l) ΔH=-123kJ/mol
B.NH2COONH4(l)(NH2)2CO(g)+H2O(g) ΔH= +50kJ/mol
①在工業生產中,尿素是由以上A、B兩步合成的,則工業上由氨氣與二氧化碳合成尿素的熱化學反應方程式為:_______________。
②尿素合成過程中通過控制溫度、NH3和CO2的物質的量比(氨碳比a)等因素來提高CO2的轉化率。如圖是在其他因素一定,不同氨碳比條件下CO2平衡轉化率與溫度的關系圖。由圖可知當溫度一定時,a值越大,CO2轉化率越大其原因是______;當a一定時,CO2平衡轉化率呈現先增大后減小的趨勢,其原因為_______。

查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】淀粉常用于合成基礎有機物的原料,某實驗小組基于淀粉的水解設計了如下合成路線。
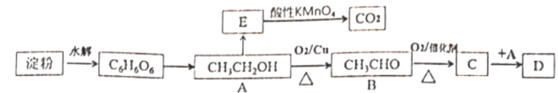
其中:E是最簡單的烯烴,D是具有水果香味的物質。
(1) E的結構簡式為_____
(2) C中的官能團名稱是____
(3)寫出A→B的化學方程式___________, 反應類型為________
(4)寫出C→D的化學方程式___________,反應類型為_________
(5)要證明淀粉已經徹底水解,選擇的檢驗試劑是_____
(6) E→CO2反應中,MnO![]() 被還原為Mn2+,寫出反應的離子方程式_______
被還原為Mn2+,寫出反應的離子方程式_______
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com