
I.設(shè)反應(yīng)①Fe(s)+CO2(g) FeO(s)+CO(g)的平衡常數(shù)為K1。反應(yīng) ②Fe(s)+H2O(g)
FeO(s)+CO(g)的平衡常數(shù)為K1。反應(yīng) ②Fe(s)+H2O(g)  FeO(s)+H2(g)的平衡常數(shù)為K2,在不同溫度下,K1、K2的值如下:
FeO(s)+H2(g)的平衡常數(shù)為K2,在不同溫度下,K1、K2的值如下:
|
T(K) |
K1 |
K2 |
|
973 |
1.47 |
2.36 |
|
1173 |
2.15 |
1.67 |
(1)現(xiàn)有反應(yīng)③CO2(g)+H2(g)  CO(g)+H2O(g),這是一個 (填“吸”或“放”)熱反應(yīng),要使平衡③向右移動,可采取的措施有
(填序號)。
CO(g)+H2O(g),這是一個 (填“吸”或“放”)熱反應(yīng),要使平衡③向右移動,可采取的措施有
(填序號)。
A.縮小反應(yīng)容器容積
B.?dāng)U大反應(yīng)容器容積
C.降低溫度
D.升高溫度
E.使用合適的催化劑
F.設(shè)法減少CO的量
(2)若反應(yīng)Fe(s)+CO2(g)  FeO(s)+CO(g)在溫度T1下進行;Fe(s)+H2O(g)
FeO(s)+CO(g)在溫度T1下進行;Fe(s)+H2O(g)
 FeO(s)+H2(g)在溫度T2下進行,已知T1>T2,且c(CO2)>c(H2O)(其他條件均相同),則兩者的反應(yīng)速率 (填序號)。
FeO(s)+H2(g)在溫度T2下進行,已知T1>T2,且c(CO2)>c(H2O)(其他條件均相同),則兩者的反應(yīng)速率 (填序號)。
A.前者大 B.后者大 C.一樣大 D.無法判斷
II.(1)鋼鐵的表面發(fā)藍、發(fā)黑處理是常用的防腐方法。請配平主要反應(yīng)的方程式:
□Na2FeO2+□NaNO2+□H2O=□NaFeO2+□NH3↑+□NaOH
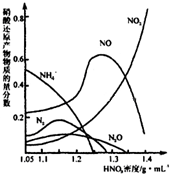
(2)鋼鐵經(jīng)冷、濃HNO3處理后“鈍化”能達到防腐目的,不同濃度的HNO3與鐵反應(yīng)的還原產(chǎn)物很復(fù)雜,其分布曲線如圖。

①圖示可知,分析HNO3與鐵反應(yīng)的規(guī)律是 。
②工業(yè)上一般不用冷濃硝酸進行鐵表面處理,其可能的原因是 。
(3)金屬(M)的腐蝕是因為發(fā)生反應(yīng):M-ne-→Mn+,除了上述表面處理的方法外,下列方法也能起到防腐作用的是 (填字母編號)
A.在鐵中摻入鉻等金屬制成不銹鋼
B.在鐵制品表面鍍鋅
C.提高鐵中含碳量,制成生鐵
D.將水庫鐵閘門與直流電源的負極相連
I.(1)吸熱(2分)D、F(2分)
(2)A(2分)
Ⅱ.(1)6Na2FeO2+NaNO2+5H2O=6NaFeO2+NH3+7NaOH(2分)
(2)①硝酸的濃度越大,其還原產(chǎn)物中氮元素化合價越高(2分)
(其它合理答案均給分,如硝酸的濃度越大,氣體生成物中二氧化氮的含量越高;或者,只有硝酸濃度較低時,產(chǎn)物中才會出現(xiàn)氮氣;等等)
②硝酸易揮發(fā),且不穩(wěn)定,見光易分解,故不易操作(1分)生成物對環(huán)境污染嚴重(1分)
(3)A、B、D(2分)
(對一個或兩個給1分,全對給2分,但只要出現(xiàn)C不給分)
【解析】
試題分析:已知:①Fe(s)+CO2(g) FeO(s)+CO(g);②Fe(s)+H2O(g)
FeO(s)+CO(g);②Fe(s)+H2O(g) FeO(s)+H2(g);利用蓋斯定律將①-②可得:③H2(g)+CO2(g)
FeO(s)+H2(g);利用蓋斯定律將①-②可得:③H2(g)+CO2(g) CO(g)+H2O(g);
CO(g)+H2O(g);
則K3=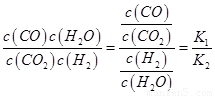 ,依據(jù)圖表平衡常數(shù)數(shù)據(jù)分析,溫度升高
,依據(jù)圖表平衡常數(shù)數(shù)據(jù)分析,溫度升高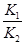 增大,說明平衡正向進行,反應(yīng)是吸熱反應(yīng);③H2(g)+CO2(g)
增大,說明平衡正向進行,反應(yīng)是吸熱反應(yīng);③H2(g)+CO2(g) CO(g)+H2O(g)反應(yīng)是吸熱反應(yīng),反應(yīng)前后氣體體積不變,要使反應(yīng)在一定條件下建立的平衡向正反應(yīng)方向移動,則
CO(g)+H2O(g)反應(yīng)是吸熱反應(yīng),反應(yīng)前后氣體體積不變,要使反應(yīng)在一定條件下建立的平衡向正反應(yīng)方向移動,則
A.縮小反應(yīng)容器容積實質(zhì)增大壓強,反應(yīng)前后氣體體積不變,平衡不動;A不符合;
B.?dāng)U大反應(yīng)容器容積,壓強減小,反應(yīng)前后氣體體積不變,平衡不動;B不符合;
C.反應(yīng)是吸熱反應(yīng),降低溫度,平衡向放熱反應(yīng)方向進行,平衡逆向進行,C不符合;
D.反應(yīng)是吸熱反應(yīng),升高溫度,平衡向吸熱反應(yīng)方向進行,平衡正向進行,D符合;
E.使用合適的催化劑,催化劑只改變反應(yīng)速率,不改變平衡,E不符合;
F.設(shè)法減少CO的濃度,減少生成物濃度平衡正向進行,F(xiàn)符合;
答案為:吸熱反應(yīng);DF;
(2)反應(yīng)速率隨溫度變化,溫度越高,反應(yīng)速率越大,所以反應(yīng)速率①大,選A.
Ⅱ、(1)Na2FeO2+NaNO2+H2O→NaFeO2+NH3↑+NaOH中,鐵元素化合價從+2價變化為+3價,氮元素化合價從+3價變化為-3價,Na2FeO2~NaFeO2~e-,NaNO2~NH3~6e-,依據(jù)電子守恒Na2FeO2的配平系數(shù)為6,NaFeO2的配平系數(shù)為6,NaNO2和NH3的配平系數(shù)為1,依據(jù)原子守恒配平NaOH,配平系數(shù)為7,H2O的配平系數(shù)為5,化學(xué)方程式為:
6Na2FeO2+NaNO2+5H2O=6NaFeO2+NH3↑+7NaOH,
答案為:6Na2FeO2+NaNO2+5H2O=6NaFeO2+NH3↑+7NaOH;
(2)①硝酸的濃度越大,氣體生成物中二氧化氮的含量越高,只在硝酸濃度較低時,產(chǎn)物中才會出現(xiàn)氮氣,答案為:硝酸濃度越大,其還原產(chǎn)物中氮元素的價態(tài)越高;
②工業(yè)上一般不用冷濃硝酸進行鐵表面處理,濃硝酸具有易揮發(fā),見光分解,生成產(chǎn)物污染空氣等性質(zhì),答案為:硝酸易揮發(fā),不穩(wěn)定,見光易分解,故不易操作,生成物對環(huán)境污染嚴重;
(3)金屬(M)的腐蝕是因為發(fā)生反應(yīng):M-ne-→Mn+,防止腐蝕是避免金屬失電子腐蝕反應(yīng);
A.在鐵中摻入鉻等金屬制成不銹鋼,原因是用鉻對鋼進行合金化處理時,把表面氧化物的類型改變成了類似于純鉻金屬上形成的表面氧化物.這種緊密粘附的富鉻氧化物保護表面,防止進一步地氧化.這種氧化層極薄,透過它可以看到鋼表面的自然光澤,使不銹鋼具有獨特的表面.而且,如果損壞了表層,所暴露出的鋼表面會和大氣反應(yīng)進行自我修理,重新形成這種“鈍化膜“,繼續(xù)起保護作用,A符合;
B.在鐵制品表面鍍鋅,鋅比鐵活潑做原電池負極,鐵做正極被保護,B符合;
C.提高鐵中含碳量,制成生鐵,含碳越高,碳和鐵在電解質(zhì)溶液中越易形成原電池,鐵做負極被腐蝕,C不符合;
D.將水庫鐵閘門與直流電源的負極相連,形成電解池,閘門做陰極被保護,D符合;
選ABD.
考點:化學(xué)平衡常數(shù)的含義;氧化還原反應(yīng)方程式的配平;化學(xué)反應(yīng)速率的影響因素;化學(xué)平衡的影響因素;金屬防護的常用方法


科目:高中化學(xué) 來源: 題型:閱讀理解
| T(K) | K1 | K2 |
| 973 | 1.47 | 2.36 |
| 1173 | 2.15 | 1.67 |
查看答案和解析>>
科目:高中化學(xué) 來源: 題型:
 I.高爐煉鐵中發(fā)生的基本反應(yīng)之一是FeO(s)+CO(g)?Fe(s)+CO2(g)△H>0.其平衡常數(shù)可表達為k=c(CO2)/c(CO),已知1100℃時,k=0.263.
I.高爐煉鐵中發(fā)生的基本反應(yīng)之一是FeO(s)+CO(g)?Fe(s)+CO2(g)△H>0.其平衡常數(shù)可表達為k=c(CO2)/c(CO),已知1100℃時,k=0.263.查看答案和解析>>
科目:高中化學(xué) 來源:2013-2014學(xué)年湖北省高三上學(xué)期12月月考化學(xué)試卷(解析版) 題型:填空題
I.設(shè)反應(yīng)①Fe(s)+CO2(g)  FeO(s)+CO(g)的平衡常數(shù)為K1。
FeO(s)+CO(g)的平衡常數(shù)為K1。
反應(yīng)②Fe(s)+H2O(g)  FeO(s)+H2(g)的平衡常數(shù)為K2,
FeO(s)+H2(g)的平衡常數(shù)為K2,
在不同溫度下,K1、K2的值如下:
|
T(K) |
K1 |
K2 |
|
973 |
1.47 |
2.36 |
|
1173 |
2.15 |
1.67 |
(1)現(xiàn)有反應(yīng)③CO2(g)+H2(g)
 CO(g)+H2O(g),這是一個 (填“吸”或“放”)熱反應(yīng),要使平衡③向右移動,可采取的措施有
(填序號)。
CO(g)+H2O(g),這是一個 (填“吸”或“放”)熱反應(yīng),要使平衡③向右移動,可采取的措施有
(填序號)。
A.縮小反應(yīng)容器容積
B.?dāng)U大反應(yīng)容器容積
C.降低溫度
D.升高溫度
E.使用合適的催化劑
F.設(shè)法減少CO的量
(2)若反應(yīng)Fe(s)+CO2(g)
 FeO(s)+CO(g)在溫度T1下進行;Fe(s)+H2O(g)
FeO(s)+CO(g)在溫度T1下進行;Fe(s)+H2O(g)
 FeO(s)+H2(g)在溫度T2下進行,已知T1>T2,且c(CO2)>c(H2O)(其他條件均相同),則兩者的反應(yīng)速率
(填序號)
FeO(s)+H2(g)在溫度T2下進行,已知T1>T2,且c(CO2)>c(H2O)(其他條件均相同),則兩者的反應(yīng)速率
(填序號)
A.前者大 B.后者大 C.一樣大 D.無法判斷
II.(1)水的電離平衡曲線如圖所示,若A點表示25℃時水的電離達平衡時的離子濃度,B點表示100℃時水的電離達平衡時的離子濃度。則100℃時1 mol·L-1的NaOH溶液中,由水電離出的c(H+)=________mol·L-1,KW(25℃)________KW(100℃)(填“>”、“<”或“=”)。25 ℃時,向水的電離平衡體系中加入少量NH4HCO3固體,對水的電離平衡的影響是________(填“促進”、“抑制”或“不影響”)。
(2)電離平衡常數(shù)是衡量弱電解質(zhì)電離程度強弱的量。已知如表數(shù)據(jù)。
|
化學(xué)式 |
電離平衡常數(shù)(25℃) |
|
HCN |
K=4.9×10-10 |
|
CH3COOH |
K=1.8×10-5 |
|
H2CO3 |
K1=4.3×10-7、K2=5.6×10-11 |
①25℃時,有等濃度的NaCN溶液、Na2CO3溶液、CH3COONa溶液,三種溶液的pH由大到小的順序為 ____。
②25 ℃時,相同濃度、相同體積的CH3COOH溶液和NaOH溶液混合, 則混合溶液中c(Na+)________c(CH3COO-)(填“>”、“<”或“=”)
③向NaCN溶液中通入少量CO2,所發(fā)生反應(yīng)的化學(xué)方程式為_______________________________。
查看答案和解析>>
科目:高中化學(xué) 來源: 題型:閱讀理解
I.設(shè)反應(yīng)①Fe(s)+CO2(g) ![]() FeO(s)+CO(g)的平衡常數(shù)為K1。
FeO(s)+CO(g)的平衡常數(shù)為K1。
反應(yīng)②Fe(s)+H2O(g) ![]() FeO(s)+H2(g)的平衡常數(shù)為K2,
FeO(s)+H2(g)的平衡常數(shù)為K2,
在不同溫度下,K1、K2的值如下:
| T(K) | K1 | K2 |
| 973 | 1.47 | 2.36 |
| 1173 | 2.15 | 1.67 |
(1)現(xiàn)有反應(yīng)③CO2(g)+H2(g) ![]() CO(g)+H2O(g),這是一個 (填“吸”或“放”)熱反應(yīng),要使平衡③向右移動,可采取的措施有 (填序號)。
CO(g)+H2O(g),這是一個 (填“吸”或“放”)熱反應(yīng),要使平衡③向右移動,可采取的措施有 (填序號)。
A.縮小反應(yīng)容器容積 B.?dāng)U大反應(yīng)容器容積 C.降低溫度
D.升高溫度 E.使用合適的催化劑 F.設(shè)法減少CO的量
(2)若反應(yīng)Fe(s)+CO2(g) ![]() FeO(s)+CO(g)在溫度T1下進行;Fe(s)+H2O(g)
FeO(s)+CO(g)在溫度T1下進行;Fe(s)+H2O(g) ![]() FeO(s)+H2(g)在溫度T2下進行,已知T1>T2,且c(CO2)>c(H2O)(其他條件均相同),則兩者的反應(yīng)速率
FeO(s)+H2(g)在溫度T2下進行,已知T1>T2,且c(CO2)>c(H2O)(其他條件均相同),則兩者的反應(yīng)速率
(填序號)
A.前者大 B.后者大 C.一樣大 D.無法判斷
II.(1)水的電離平衡曲線如圖所示,若A點表示25℃時水的電離達平衡時的離子濃度,B點表示100℃時水的電離達平衡時的離子濃度。則100℃時1 mol·L-1的NaOH溶液中,由水電離出的c(H+)=________mol·L-1,KW(25℃)________KW(100℃)(填“>”、“<”或“=”)。25 ℃時,向水的電離平衡體系中加入少量NH4HCO3固體,對水的電離平衡的影響是________(填“促進”、“抑制”或“不影響”)。

(2)電離平衡常數(shù)是衡量弱電解質(zhì)電離程度強弱的量。已知如表數(shù)據(jù)。
| 化學(xué)式 | 電離平衡常數(shù)(25℃) |
| HCN | K=4.9×10-10 |
| CH3COOH | K=1.8×10-5 |
| H2CO3 | K1=4.3×10-7、K2=5.6×10-11 |
①25℃時,有等濃度的NaCN溶液、Na2CO3溶液、CH3COONa溶液,三種溶液的pH由大到小的順序為_______ ____。
②25 ℃時,相同濃度、相同體積的CH3COOH溶液和NaOH溶液混合,
則混合溶液中c(Na+)________c(CH3COO-)(填“>”、“<”或“=”)
③向NaCN溶液中通入少量CO2,所發(fā)生反應(yīng)的化學(xué)方程式為
___________________________________________________________________。
查看答案和解析>>
國際學(xué)校優(yōu)選 - 練習(xí)冊列表 - 試題列表
湖北省互聯(lián)網(wǎng)違法和不良信息舉報平臺 | 網(wǎng)上有害信息舉報專區(qū) | 電信詐騙舉報專區(qū) | 涉歷史虛無主義有害信息舉報專區(qū) | 涉企侵權(quán)舉報專區(qū)
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com